Nội dung toàn văn Tiêu chuẩn ngành 10 TCN 819:2006 về quy trình phân lập và giám định Streptococcus Suis
TIÊU CHUẨN NGÀNH
10 TCN 819:2006
QUI TRÌNH PHÂN LẬP VÀ GIÁM ĐỊNH STREPTOCOCCUS SUIS
Procedure for isolation and identification of Streptococcus suis
1. Phạm vi áp dụng
Qui trình này áp dụng cho công tác xét nghiệm trong phong thí nghiệm.
2. Khái niệm
– Streptococcus suis là nguyên nhân của nhiều quá trình bệnh lý như viêm màng não, nhiễm trùng huyết trong thời kỳ sơ sinh, viêm cuống phổi, viêm khớp và rối loạn sinh sản (Tarradas C. và CS., 1994)
– Nhiều chủng S. suis có khả năng gây bệnh cho lợn. Hai chủng huyết thanh quan trong là S. suis typ 1 (nhóm S) và typ 2 (nhóm R),
– S. suis type 1 (S) thường gây bệnh cho lợn con từ 2 – 4 tuần tuổi
– S. suis type 2 (R) gây bệnh cho lợn từ sau cai sữa cho đến 6 tháng tuổi
– Người làm công tác thú y, tiếp xúc thường xuyên với lợn hoặc thịt lợn tưoi sống có thể bị nhiễm S. suis type 2 và mắc bệnh viêm màng não, viêm nội tâm mạc và nhiễm trùng huyết.
3. Nguyên liệu và dụng cụ
3.1 máy móc
– Tủ ấm 37oC
– Tủ sấy
– Buồng cấy
– Kính hiển vi có vật kính dầu, vật kính khô hoặc phản pha
– Nồi hấp ướt
– Cân điện
– Tủ lạnh
– Lò vi sóng
3.2 Dụng cụ
– Panh, kéo nhỏ
– Đèn cốn
– Que cấy
– Đĩa petri để đổ môi trường
– Lam kính
– Kính lúp
– Lamen (coverslip)
3.3 Môi trường – hoá chất – Nguyên liệu
– Môi trường chọn lọc Streptococcus (Edward medium hoặc thạch máu có bổ xung polymicin B và crystal violet)
– Môi trường thạch máu cừu/bò
– Môi trường đường inulin, mannitol, raffinose, trehalose,
– Môi trường Voges- Proskauer (VP)
– Môi trường nước thịt có 6,5% Nacl.
– Huyết thanh chuẩn streptococcus nhóm D (R,S)
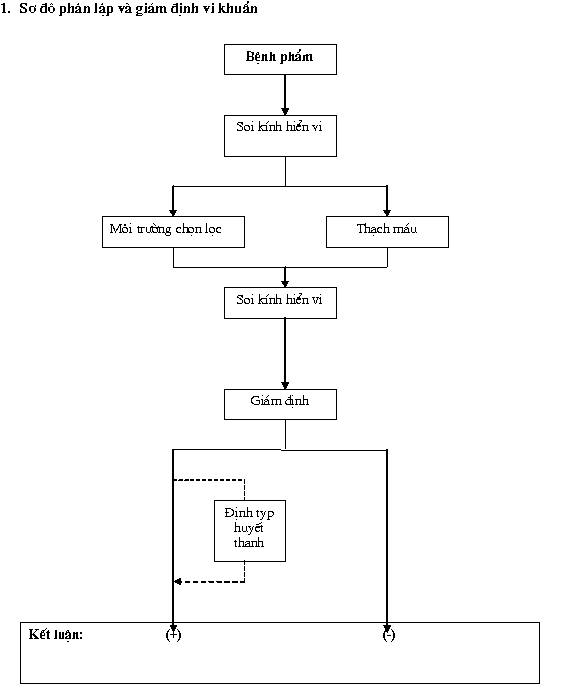
1. Lấy mẫu bệnh phẩm
– Mẫu xét nghiệm là hạch amidan, phổi, các phủ tạng, máu (thể nhiễm trùng huyết), dịch rỉ viêm, dịch khớp và mủ.
2. Soi kính hiển vi
– Mủ và khuẩn lạc sau khi phân lập được dùng để phết kính nhuộm gram
– Vi khuẩn streptococcus suis bắt màu gram (+) có dạng hình cầu hơi dài hoặc hình quả trứng thường đứng đơn lẻ, xếp đôi, ít khi chuỗi ngắn.
3. Phân lập
– Xử lý vô trùng phía ngoài (đối với các bệnh phẩm là tổ chức) bằng đốt nóng cán panh rồi áp vào bề mặt ngoài của tổ chức. Tổ chức ở phía trong được dùng cho phân lập vi khuẩn.
– Bệnh phẩm được cấy lên các loại môi trường thạch máu (bò, ngựa, cừu) và môi trường chọn lọc (chuẩn bị môi trường xem phụ lục), nuôi cấy ở 37oC, trong 24 h
– Khuẩn lạc S. suis mọc sau thời gian nuôi cấy có dạng nhỏ (khoảng 1-2mm) tròn trơn bóng láng hoặc nhẵn, thường gây dung huyết alfa hoặc không dung huyêt.
– Các khuẩn lác nghi S.suis cần phải được giám định
4. Giám định vi khuẩn
– Để giám định VK S. suis có thể dùng 1 trong số những kit thương mại như API 20S, rapid STREP (Analytab Products) hay RapID STR system (Innovative Diagnostic System) và theo hướng dẫn sử dụng của nhà sản xuất.
Hoặc không, dựa vào một số tính chất cơ bản sau của streptococcus suis (bảng 1) để giám định:
(Các phương pháp để kiểm tra các tính chất sinh hoá trên được mô tả trong phần phụ lục)
Bảng 1: Một số tính chất cơ bản của Streptococcus suis dùng cho giám định
|
Chủng streptococcus |
Nhóm huyết thanh |
Tính chất dung huyết |
H ình thái khuẩn lạc |
Voges- Proskauer |
Thuỷ phân aesculin |
inulin |
Lactose |
Mannitol |
Raffinose |
Trehalose |
Mọc trên 6,5% NaCl |
|
S. suis type 1 |
D(S) |
α, β, KDH |
nhỏ, tròn trơn |
– |
– |
+ |
– |
– |
– |
+ |
– |
|
S. suis type 2 |
D(R) |
α, KDH |
nhỏ, tròn trơn |
– |
+ |
(+) |
– |
– |
(+) |
+ |
– |
* Theo Tarradas C. và cộng sự 1994; Quinn P.L. và Carter G.R., 1994.
5. Định typ huyết thanh
– Vi khuẩn sau giám định cần phải được kiểm tra tính chất kháng nguyên theo phân nhóm Lancefield bằng kit thương mại Latex Agglutination test cho S. suis (Wellcome Diagnostics; Difco laboratories; Scott Laboratories và Diagnostic Products Corporation).
6. Tài liệu tham khảo
Quinn P.L. và Carter G.R. 1994. Veterinary clinical microbiology. USA
Swine disease. 1994, USA.
Cẩm nang chẩn đoán tiêu chuẩn về các bệnh gia súc ở Việt Nam. 2002, Viện thú y quốc gia – JICA.
Sydney M. F. and Ellen J. B. 1986. Bailey Diagnostic and Scott’s Microbiology. Ed 7th. The C. V. Moshy Company, Missouri, USA.
Richard F. 2002. What Happened to the Streptococci: Overview of Taxonomic and Nomenclature Changes. Clinical Microbiology Reviews, 15; 4, p. 613-630.
Tarradas C., Arenas A., Maldonado A., Luque I., Miranda A. and Perea A. 1994. identification of Streptococcus suis Isolated from Swine: Proposal for Biochemical Parameters. Journal of Clinical Microbiology, 32; 2 p. 578-580.
Ashish A. S., Shreekumar R. P. and Bhushan M. J. 2002. Evaluation of five selective media for isolation of catalase-negative gram-positive cocci from bulk tank milk. Journal of dairy science, 85, p 1127-1132.
Gottschalk M., Higgins R. ans Boudreau M. 1993. Use of polyvalent coagglutination reagents for serotyping of streptococcus suis. Journal of Clinical Microbiology. 31; 8, p. 2192-2194.
Florence B. H., Roland C., Annie L., Marcelo G., Jean-Yves C. and Marylene K. 2001. The Canadian journal of veterinary research. 65, p. 196-200.
Gottschalk M., Lacouture S. and Odierno L. 1999. Immunomagnetic isolation of streptococcus serotypes 2 and from swine tonsils. Journal of clinical microbiology. 37; 9, p. 2877-2881
|
|
KT. BỘ TRƯỞNG |
PHỤ LỤC
1. Chuẩn bị thạch máu
Nguyên liêu:
– Thạch máu cơ bản/ Blood agar base
– Máu cừu/bò sạch bệnh
– Nước cất
Chuẩn bị theo hướng dẫn của nhà sản xuất
– Thạch máu cơ bản được hoà với nước cất theo tỉ lệ rồi đun cho tan hết, sau đó hấp ở 121oC 15 phút. Sau khi hấp để nguội đến khoảng 37oC thi cho thêm 5-7% máu cừu hoặc bò, lắc nhẹ cho đều rồi đổ ra đĩa Petri.
2. Chuẩn bị môi trường chọn lọc
Hiện nay có rât nhiêu loại môi trường dùng cho phân lập vk Streptococcus tuy nhiên những loại môi trường sau thường hay được dùng.
a) Edwards modified medium
Nguyên liệu:
– Edwards modified medium
– Máu cừu/bò
– Colistin
– Oxonlinic acid
– Nước cất
Chuẩn bi
– sau khi chuẩn theo hướng dẫn của nhà sản xuất có thể bổ xung colistin 5 mg/L and oxonlinic acid 2,5 mg/L and 5% máu cừu/bò để làm tăng khả năng mọc của vi khuẩn.
Vì trong môi trường Edward có chứa aesculin nên môi trường này có thể dùng để kiểm tra tính chât thuỷ phân aesculin của vi khuân có thể nhận biết nếu khuẩn lạc và môi trường có màu đen (hay dương tính thuỷ phân aesculin)
b) Môi trường thạch máu được bổ xung polymyxin B và Crystal violet
– Thạch máu cơ bản/ Blood agar base
– Máu cừu/bò sạch bệnh
– Nước cất
– polymyxin B
– Crystal violet
Chuẩn bị
– Môi trường thạch máu sau chuẩn bi theo hướng dẫn của nhà sản xuất như đă nói ở phần chuẩn bị thạch máu được bổ xung thêm polymyxin B 10 mg/L và Crystal violet 1mg/L ngay sau khi cho máu vào môi trường.
3. Phương pháp kiểm tra khả năng sản sinh acetoin trong môi trường VP
Các môi trường và hoá chất cần có bao gồm:
a) Môi trường VP thương phẩm, có chứa peptoné, glucose và buffer
Chuẩn bị như sau:
Buffered peptone 7g
Glucose 5g
Dipotasium phosphate 5g
Nước cất 1000ml
b) Thuốc thử A
Alpha naphthol (Sigma Chemical Co.) 5g
Ethyl alcohol (thuần khiết) 100ml
Hoà tan Alpha naphthol trong một lượng nhỏ Ethyl alcohol rồi đổ thêm cho đủ 100 ml trong bình thuỷ tinh tam giác. Giữ trong lọ nâu ở nhiệt độ 4oC
c) Thuốc thử B
Potassium hydroxide (KOH) 40g
Nước cất 100ml
– KOH phải được pha trong bình thuỷ tinh đặt trong nước lạnh để tránh sinh nhiệt. Khi cân KOH phải cân thật nhanh vì KOH dễ hút ẩm và là chất ăn da khi bị ẩm, sau đó cho vào bình thuỷ tinh rồi cho một lượng khoảng 90ml nước cất. Sau khi lắc cho tan thì cho thêm 10ml cho đủ lượng. Chất thử này được giữ trong bình nhưa ở nhiệt độ 4oC.
d) Phương pháp kiểm tra:
– Sau khi nuôi cấy vi khuẩn phân lập được trong môi trường VP ít nhất 48 giờ ở nhiệt độ 37oC lấy 2,5 ml canh trùng cho vào 1 ống nghiệm nhỏ vô trùng. Sau đó cho 0,6 ml (6 giọt) thuốc thử A rồi 0,2 ml (2 giọt) thuốc thử B. Sau khi cho các thuốc thử , lắc nhẹ ống nghiệm rồi để 15 phút đem đọc kết quả:
– Nếu môi trường có màu hồng là phản ứng dương tính, màu vàng hoặc không màu là âm tính.
4. Phương pháp kiêm tra khả năng thuỷ phân aesculin
– Có thể dùng môi trường Edward để kiểm tra tính chất này như đă nói ở phần chuẩn bị môi trường Edward.
– Hoặc có thể dùng môi trường lỏng có chứa aesculin được chuẩn bị như sau để kiẻm tra
Aesculin 1g
Peptone water 1000ml
Feric cirtate 0,5 g
Sau khi cho các thành phần vào với nhau, lắc cho tan rồi hấp ở 115oC trong 10 phút. Giữ ở nhiệt độ 4oC. Nuôi cấy trong môi trường này ở 37oC và theo dõi trong 7 ngày nếu môi trường chuyển từ màu nâu sậm sang màu đen là dương tính.
5. Phương pháp kiểm tra khả năng lên men đường (inulin, lactose, mannitol, raffinose, trehalose).
a) Chuẩn bị môi trường
Peptone water 100ml
Chỉ thị màu andrade 1ml
Sau khi cho các thành phần vào với nhau, lắc cho đều rồi chia vào các ống nghiệm, mỗi ống 4 ml.
b) Chỉ thị mau andrade
Fucsin acid 0,5g
Nước cất 100ml
Dung dịch NaOH-1N 16ml
– Nghiền fucsin trong cối sứ nhỏ mịn rồi hoà vào nước cất cho tan hết. Cho vào từ từ dung dịch NaOH-1N, vừa cho vừa lắc đến khi nào mầu từ đỏ tươi chuyển thành đỏ nâu, rồi đến khi vàng úa, vàng thẫm thì thôi (lượng NaOH nhỏ vào thường từ 12-17 ml, trung bình 16 ml là vừa). Để lắng 1-2 giờ rồi lọc qua giấy lọc. Hấp ướt 120oC trong 15 phút.
c) Dung dịch đường
Trehalose 10g
Nước cất 100ml
Hoà tan Trehalose (inulin, lactose, mannitol, raffinose) trong nước cất rồi hấp ở 110oC trong vòng 20 – 30 phút. Dung dịch đường được giữ ở nhiệt độ 4oC.
d) Phương pháp kiểm tra:
– Mỗi ống môi trường peptone có chỉ thị màu andrade (4ml) được cho 0,3 ml dung dịch đường. Cấy giống vi khuẩn phân lập được vào môi trường rồi để tủ ấm 37oC sau 24 giờ lấy ra đọc kết quả.
– Nêu môi trường không thay đổi màu. màu vẫn vàng tức là vk không sinh acid, phản ứng âm tính.
– Nếu môi trường chuyển từ màu vàng sang đỏ tức là vi khuẩn sinh acid, phản ứng dương tính
6. Phương pháp kiểm tra khả năng mọc trên môi trường có 6,5% NaCl
a) Chuẩn bị môi trường
Nước Peptone 100ml
NaCl 6,5g
– Cho các thành phần vào nhau rồi lắc cho tan, chia vào các ống (mỗi ống 5ml) sau đó hấp ướt ở 110oC trong vòng 20 phút. Cất ở 4oC.
b) Phương pháp kiểm tra
– Cây vi khuẩn vào ống môi trường để ở 37oC sau 24 giờ đem ria cấy lại trên môi trường chọn lọc nếu có vi khuẩn mọc trên môi trường chọn lọc có nghĩa là vi khuẩn đã sống được trong môi trường có 6,5% NaCl. Ngược lại vi khuẩn không có khả năng mọc trong môi trường có 6,5% NaCl .


