Nội dung toàn văn Tiêu chuẩn ngành 28 TCN 194:2004 về các chất chuyển hoá thuộc nhóm nitrofuran trong thuỷ sản và sản phẩm thuỷ sản – Phương pháp định lượng bằng sắc ký lỏng khối phổ-khối phổ do Bộ Thuỷ sản ban hành
TIÊU CHUẨN NGÀNH
28 TCN 194:2004
CÁC CHẤT CHUYỂN HOÁ THUỘC NHÓM NITROFURAN TRONG THUỶ SẢN VÀ SẢN PHẨM THUỶ SẢN – PHƯƠNG PHÁP ĐỊNH LƯỢNG BẰNG SẮC KÝ LỎNG KHỐI PHỔ-KHỐI PHỔ
Residues of metabolites of nitrofurans group in fishery products – Method for quantitative analysis by LC/MS/MS
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp xác định hàm lượng của các chất chuyển hoá thuộc nhóm nitrofuran gồm furazolidon, furaltadon, nitrofurantoin và nitrofurazon trong thủy sản và sản phẩm thủy sản. Giới hạn phát hiện của phương pháp là 1 mg/kg.
2. Phương pháp tham chiếu
Tiêu chuẩn này được xây dựng dựa theo phương pháp của Viện Kiểm soát Chất lượng sản phẩm nông nghiệp Hà lan (RIKILT).
3. Giải thích thuật ngữ và các từ viết tắt
3.1 Giải thích thuật ngữ
Trong Tiêu chuẩn này, các thuật ngữ dưới đây được hiểu như sau:
3.1.1 Dư lượng liên kết với mô là các chất tồn dư do có các liên kết đồng hoá trị với các đại phân tử trong cơ thể động vật.
3.1.2 Ion sơ cấp (precursor ion) là ion được tạo ra và chọn lọc sau giai đoạn MS thứ nhất, thông thường, nhưng không nhất thiết nó là một ion phân tử mang điện dương.
3.1.3 Ion thứ cấp (product ion) là ion được tạo ra và chọn lọc trong giai đoạn MS thứ hai, ion này được sinh ra từ ion sơ cấp trong quá trình phân ly do va chạm.
3.2 Các từ viết tắt
3.2.1 LC/MS/MS: Sắc kí lỏng/khối phổ/khối phổ.
3.2.2 CID (Collision induced dissociation): phân ly do va chạm.
3.2.3 ESI (Electron spray ionization): ion hoá bằng phun điện tử.
3.2.4 HPLC: Sắc ký lỏng hiệu năng cao.
4. Nguyên tắc
Dư lượng liên kết với mô của các chất chuyển hoá nhóm nitrofuran trong sản phẩm thuỷ sản được thuỷ phân bằng axit clohyđric loãng để thu được mạch nhánh của các chất nhóm nitrofuran. Các mạch nhánh này được dẫn xuất hoá bằng 2-nitrobenzalđehyt. Định tính và định lượng các chất dẫn xuất bằng LC/MS/MS bằng cách sử dụng các đồng vị đơtơri như chất chuẩn nội.
5. Thiết bị, dụng cụ, hóa chất, dung dịch
5.1 Thiết bị, dụng cụ
5.1.1 Cân phân tích, độ chính xác 0,01 mg.
5.1.2 Cân phân tích, độ chính xác 0,01 g.
5.1.3 Máy nghiền
5.1.4 Máy ly tâm
5.1.5 Tủ ấm (có thể điều chỉnh được ở khoảng nhiệt độ 37oC ± 2oC)
5.1.6 Hệ thống cô bằng khí Nitơ
5.1.7 Máy lắc Vortex.
5.1.8 Màng lọc PTFE, 13mm, 0,45mm.
5.1.9 Giấy thử pH
5.1.10 Pipet 100ml
5.1.11 Hệ thống LC/MS/MS:
– Hệ thống sắc kí lỏng: Water Alliance 2690 hoặc tương đương gồm bơm và hệ thống tiêm mẫu;
– Cột bảo vệ pha đảo C18 (Symmetry Sentry Guard hoặc tương đương), kích thước 20 x 3,9mm;
– Cột C18 (Symmetry hoặc tương đương) kích thước150 x 3,0 mm, 5mm,
– Đầu dò khối phổ dạng bốn cực với giao diện ESI (Triple quadrupole Micromass Quattro Ultima hoặc tương đương).
5.1.12 Ống ly tâm 14ml, polypropylen hoặc thuỷ tinh, có nắp đậy
5.1.13 Máy lắc ống nghiệm
5.1.14 Lọ đựng mẫu cho HPLC
5.1.15 Bình định mức 10ml, 20ml, 100ml
5.1.16 Dụng cụ thủy tinh thông thường.
5.1.17 Máy lắc đảo đầu (Heidolf REAX2) hoặc tương đương
5.2 Hóa chất
Hoá chất phải là loại tinh khiết được sử dụng để phân tích gồm:
5.2.1 Metanol
5.2.2 Axit clohydric (HCl) 32%.
5.2.3 2-nitrobenzalđehyt (C7H5NO3) viết tắt làNBA.
5.2.4 Natri phosphat ngậm nước Na3PO4.12H2O.
5.2.5 Natri hyđroxyt khan (NaOH).
5.2.6 Etyl axetat (CH3COOC2H5).
5.2.7 Axit axetic (CH3 COOH).
5.2.8 Axetonitril (CH3CN).
5.2.9 Metanol -d, 99,5% D.
5.2.10 Nước
5. 3 Chất chuẩn
5.3.1 3-amino-2-oxazolidinon (AOZ).
5.3.2 5-metylmorfolino-3-amino-2-oxazolidinon (AMOZ).
5.3.3 1-amino-hyđantoin hyđroclorit (AHD).
5.3.4 Semicarbazit (SEM) hyđroclorit.
5.3.5 3-amino-2- oxazolidinon-d4 hyđroclorit (AOZ-d4).
5.3.6 5-metylmorfolino-3-amino-2-oxazolidinon-d5 (AMOZ-d5).
5.3.7 1-amino-hyđantoin hyđroclorit-d2 (AHD-d2).
5.3.8 3-((2-nitrophenyl)metylen)-amino-2-oxazolidinon (NPAOZ).
5.3.9 5-metylmorfolino-3-((2-nitrophenyl)metylen)-3-amino-2-oxazolidinon (NPAMOZ).
5.3.10 1-((2-nitrophenyl)metylen)-amino-hyđantoin (NPAHD).
5.3.11 (2-nitrophenyl) metylen-semicarbazit (NPSEM).
5.4 Chuẩn bị các dung dịch
5.4.1 Axit clohyđric 0,2M: hoà tan 20 ml HCl (5.2.2) trong 1000ml nước (5.2.10).
5.4.2 Natri hyđroxit 2M: hoà tan 80g NaOH khan (5.2.5) vào 1000ml nước (5.2.10).
5.4.3 2-nitrobenzalđehyt (NBA) 100mM trong metanol nồng độ 0,1M: hoà tan 1,51g NBA (5.2.3) vào 100ml metanol (5.2.1).
5.4.4 Natri phosphat 0,3M: hoà tan 11,4 g Na3PO4.12H2O (5.2.4) vào 100ml nước (5.2.10).
5.4.5 Dung môi hoà tan mẫu: trộn 50ml axetonitril (5.2.8), 450 ml nước (5.2.10) và 0,5 ml axit axetic (5.2.7).
5.4.6 Pha động A: trộn 1ml axit axetic (5.2.7) với 1000ml nước (5.2.10), lọc qua màng lọc 0,45mm (5.1.8).
5.4.7 Pha động B: trộn 900ml axetonitril (5.2.8) với 100ml nước (5.2.10) và 1ml axit axetic (5.2.7), lọc qua màng lọc 0,45mm (5.1.8).
5.5 Các dung dịch chuẩn
5.5.1 Các dung dịch chuẩn gốc
5.5.1.1 Dung dịch chuẩn gốc AOZ, AMOZ, AHD, SEM, AOZ-d4, AMOZ-d5, NPAOZ, NPAMOZ, NPAHD, NPSEM (50mg/l trong metanol)
Cân chính xác từ khoảng 1 đến 5 mg ± 0,02mg các chất chuẩn nói trên. Chuẩn bị các dung dịch chuẩn gốc bằng cách hoà tan trong metanol (5.2.1), lưu ý đến độ tinh khiết của chất chuẩn.
5.5.1.2 Dung dịch chuẩn gốc AHD-d2 (50mg/l trong metanol-d)
Cân chính xác từ khoảng 1 đến 5 mg ± 0.02mg các chất chuẩn nói trên. Chuẩn bị các dung dịch chuẩn gốc bằng cách hoà tan trong metanol-d (5.2.9), lưu ý đến độ tinh khiết của chất chuẩn.
5.5.2 Hỗn hợp các dung dịch chuẩn
5.5.2.1 Hỗn hợp MM1 (1mg/l trong metanol) gồm AOZ, AMOZ, AHD, SEM
Lấy 200 ml từ mỗi dung dịch gốc AOZ, AMOZ, AHD, SEM (5.5.1.1) cho vào bình định mức 10ml, định mức đến vạch với metanol (5.2.1).
5.5.2.2 Hỗn hợp IS1 (1 mg/l trong metanol-d) gồm AOZ-d4, AMOZ-d5,AHD-d2
Lấy 200 ml từ mỗi dung dịch gốc AOZ-d4, AMOZ-d5 (5.5.1.1) và AHD-d2 (5.5.1.2) cho vào bình định mức 10ml, định mức đến vạch với metanol-d (5.2.9).
5.5.2.3 Hỗn hợp NP1 (1mg/l trong metanol) gồm NPAOZ, NPAMOZ, NPAHD, NPSEM
Lấy 460 ml dung dịch gốc NPAOZ (5.5.1.1), 332 ml dung dịch gốc NPAMOZ (5.5.1.1), 432 ml dung dịch gốc NPAHD (5.5.1.1) và 554 ml dung dịch gốc NPSEM (5.5.1.1) cho vào bình định mức 10 ml. Định mức đến vạch với metanol (5.2.1).
5.5.3 Pha loãng các hỗn hợp dung dịch chuẩn
5.5.3.1 Hỗn hợp chuẩn MM2 (50 mg/l trong metanol) gồm AOZ, AMOZ, AHD, SEM
Lấy 1,00 ml hỗn hợp chuẩn MM1 (5.5.2.1) cho vào bình định mức 20ml, định mức đến vạch với metanol (5.2.1).
5.5.3.2 Hỗn hợp chuẩn nội IS2 (50 mg/l trong metanol-d) gồm AOZ-d4, AMOZ-d5,AHD-d2
Lấy 1,00 ml hỗn hợp chuẩn IS1 (5.5.2.2) cho vào bình định mức 20ml, định mức đến vạch với metanol-d (5.2.9).
5.5.3.3 Hỗn hợp chuẩn NP2 (100 mg/l trong metanol) gồm NPAOZ, NPAMOZ, NPAHD, NPSEM
Lấy 2,00 ml hỗn hợp chuẩn NP1 (5.5.2.3) cho vào bình định mức 20ml, định mức đến vạch với metanol (5.2.1).
5.5.4 Dung dịch chuẩn làm việc của các dẫn xuất nitrophenyl – WS1 (1mg/l)
Lấy 1,00 ml hỗn hợp chuẩn NP2 (5.5.3.3) cho vào bình định mức 1000ml, định mức đến vạch với dung môi hoà tan mẫu (5.4.5).
Tất cả các dung dịch chuẩn phải được bảo quản trong bóng tối ở nhiệt độ 4oC. Các dung dịch chuẩn gốc có thể sử dụng trong 1 năm. Các hỗn hợp chuẩn có thể sử dụng trong 1 tháng. Dung dịch chuẩn làm việc (5.5.4) có thể sử dụng trong 1 tuần.
6. Phương pháp tiến hành
6.1 Chuẩn bị mẫu
6.1.1 Mẫu thử nghiệm
Cân chính xác 1,0 ± 0,05 g mẫu cần kiểm nghiệm đã được đồng nhất bằng máy nghiền (5.1.3) cho vào ống ly tâm 14ml (5.1.12). Bổ sung 40ml hỗn hợp chuẩn nội IS2 (5.5.3.2), đồng nhất và để yên trong 15 phút.
6.1.2 Mẫu kiểm soát chất lượng
6.1.2.1 Mẫu kiểm soát âm tính: mẫu trắng không chứa AOZ, AMOZ, AHD và SEM
Cân chính xác 1,0 ± 0,05 g mẫu trắng (đã được chứng nhận), bỏ vào ống ly tâm 14ml (5.1.12). Bổ sung 40 ml hỗn hợp chuẩn nội IS2 (5.5.3.2) và để yên trong 15 phút. Sau đó, tiến hành thuỷ phân và dẫn xuất hoá theo qui định tại Điều 6.2.1.
6.1.2.2 Mẫu kiểm soát dương tính: mẫu trắng được bổ sung AOZ, AMOZ, AHD và SEM
Cân chính xác 4 phần có khối lượng 1,0 ± 0,05 g mẫu trắng (đã được chứng nhận), bỏ vào 4 ống ly tâm 14ml (5.1.12). Bổ sung các dung dịch chuẩn theo cách ghi trong Bảng 1 rồi để yên trong 15 phút. Sau đó, tiếp tục thuỷ phân và dẫn xuất hoá theo qui định tại Điều 6.2.1.
Bảng 1 – Chuẩn bị mẫu kiểm soát dương tính
|
Nồng độ trong mẫu (mg/kg) |
Hỗn hợp chuẩn MM2 (5.5.3.1) (ml) |
Hỗn hợp chuẩn nội IS2 (5.5.3.2) (ml) |
|
0,5 |
10 |
40 |
|
1 |
20 |
40 |
|
2 |
40 |
40 |
|
5 |
100 |
40 |
6.1.2.3 Mẫu kiểm soát độ thu hồi: mẫu trắng bổ sung các chất dẫn xuất nitrophenyl của AOZ, AMOZ, AHD và SEM chuẩn.
Cân chính xác 2 phần có khối lượng 1,0 ± 0,05 g mẫu trắng (đã được chứng nhận), bỏ vào 2 ống ly tâm 14ml (5.1.12). Bổ sung 40ml dung dịch chuẩn nội IS2 (5.5.3.2) rồi để yên trong 15 phút. Sau đó, tiếp tục thuỷ phân và dẫn xuất hoá theo qui định tại Điều 6.2.1.
Sau khi làm bay hơi etyl axetat (6.2.3), thêm vào một mẫu 20ml hỗn hợp chuẩn NP2 (5.5.3.3) và 480ml dung môi hoà tan mẫu (5.4.5). Thêm vào một mẫu khác 50ml hỗn hợp chuẩn NP2 (5.5.3.3) và 450ml dung môi hoà tan mẫu (5.4.5). Sau đó, tiến hành chuẩn bị mẫu phân tích (6.2.4) với công đoạn lọc.
6.2 Xử lý mẫu
Chú thích: Vì các chất dẫn xuất nitrophenyl rất nhậy với ánh sáng nên toàn bộ qui trình xử lý mẫu phải được tiến hành dưới ánh sáng yếu (ánh sáng vàng).
6.2.1 Thuỷ phân và dẫn xuất hoá
Thêm 5 ml axit clohyđric 0,2M (5.4.1) và 50ml dung dịch 2-NBA trong metanol (5.4.3)vào các ống nghiệm chứa mẫu (6.1.1; 6.1.2.1; 6.1.2.2; 6.1.2.3). Đậy nắp ống và lắc bằng tay để phân tán mẫu. Đặt lên máy lắc ống nghiệm (5.1.13) rồi đặt cả hệ thống vào trong tủ ấm. Ủ mẫu qua đêm ở nhiệt độ 37 ± 2oC.
6.2.2 Trung hoà
Sau khi làm nguội, thêm 500 ml dung dịch Na3PO4 0,3M (5.4.4) vào mẫu. Lắc mẫu bằng tay. Điều chỉnh pH về 7±0,5 bằng dung dịch NaOH 2M (5.4.2), kiểm tra pH bằng giấy thử pH (5.1.9). Lắc bằng tay và để yên trong 5 phút. Kiểm tra lại pH và điều chỉnh thêm nếu cần thiết.
6.2.3 Chiết
Thêm 4ml etyl axetat (5.2.6) vào mẫu đã điều chỉnh pH. Chiết mẫu bằng cách đặt trên máy lắc đảo đầu (5.1.17) trong 20 phút. Ly tâm mẫu trong 10 phút ở tốc độ 2000 vòng/phút. Chuyển lớp hữu cơ ở phía trên sang một ống ly tâm 14ml (5.1.12) sạch. Lặp lại bước chiết bằng cách thêm 4ml etyl axetat (5.2.6) vào phần mẫu còn lại, đóng nắp ống ly tâm rồi đặt trên máy lắc đảo đầu (5.1.17) trong 20 phút. Ly tâm mẫu trong 10 phút ở tốc độ 3500 vòng/phút. Lấy lớp hữu cơ và kết hợp với phần hữu cơ đã lấy ở lần đầu rồi làm bay hơi cho đến khô ở nhiệt độ 45oC với hệ thống cô bằng khí nitơ (5.1.6) với tốc độ dòng khí chậm.
Chú thích: tổng thể tích phần hữu cơ phải lớn hơn 6 ml, nếu không phải chiết thêm một lần nữa.
6.2.4 Chuẩn bị mẫu phân tích
Hoà tan cặn khô bằng 500ml dung môi hoà tan mẫu (5.4.5), lắc trên máy lắc Vortex (5.1.7) trong 20 giây. Lọc dịch đục qua màng lọc 13mm, 0,45mm (5.1.8) và thu dịch lọc vào lọ vial cho HPLC (5.1.14).
6.2.5 Phân tích trên LC/MS/MS
6.2.5.1 Điều kiện máy LC
a. Tốc độ: 0,4 ml/phút;
b. Thể tích mẫu tiêm: 50 ml;
c. Nhiệt độ cột: 40oC;
d. Toàn bộ thời gian phân tích: 22 phút;
đ. Pha động: chế độ gradien theo Bảng 2
Bảng 2 – Điều kiện gradien dung môi của máy LC
|
Thời gian (phút) |
Pha động A (5.4.6) (%) |
Pha động B (5.4.7) (%) |
|
0 |
90 |
10 |
|
1 |
90 |
10 |
|
14 |
55 |
45 |
|
16 |
10 |
90 |
|
18 |
10 |
90 |
|
19 |
90 |
10 |
6.2.5.2 Điều kiện của đầu dò MS
a. Tỉ số chia: xấp xỉ 1 : 2
b. Kiểu ion hoá: ESI, dương
c. Điện thế mao quản: 2,7 kv
d. Điện thế khối nón: 30 v
đ. Nhiệt độ nguồn: 120oC
e. Nhiệt độ khử dung môi: 300oC
g. Tốc độ dòng khí khử dung môi: 500 l/h
h. Tốc độ khí qua khối nón: 200 l/h
i. Khí gây phân ly bằng va chạm: Argon, p = 3,2.10-3 bar.
6.2.5.3 Điều kiện phân ly MS/MS
NPAOZ, NPAMOZ, NPAHD và NPSEM bị phân ly thành các ion thứ cấp liên quan đến cấu trúc. Các chất đồng vị đánh dấu được sử dụng làm chất chuẩn nội cũng có cách phân ly tương tự (Bảng 3).
Bảng 3 – Các điều kiện phân ly MS/MS
|
Thành phần |
Ion sơ cấp (m/z) |
Ion thứ cấp (m/z) |
Thời gian lưu (s) |
Năng lượng va chạm (eV) |
Cửa sổ (phút) |
|
NPAMOZ |
335 ± 0,5 |
262 ± 0,5 291 ± 0,5 |
0,3 0,3 |
15 15 |
0,0 – 8,5 0,0 – 8,5 |
|
NPAMOZ-d5 |
340 ± 0,5 |
296 ± 0,5 |
0,3 |
15 |
0,0 – 8,5 |
|
NPAHD |
249 ± 0,5 |
134 ± 0,5 178 ± 0,5 |
0,2 0,2 |
15 15 |
8,5 – 13,0 8,5 – 13,0 |
|
NPAHD-d2 |
251 ± 0,5 |
134 ± 0,5 |
0,2 |
15 |
8,5 – 13,0 |
|
NPSEM |
209 ± 0,5 |
166 ± 0,5 192 ± 0,5 |
0,2 0,2 |
10 10 |
8,5 – 13,0 8,5 – 13,0 |
|
NPAOZ |
236 ± 0,5 |
104 ± 0,5 134 ± 0,5 |
0,3 0,3 |
17 17 |
13,0 -18,0 13,0 -18,0 |
|
NPAOZ-d4 |
240 ± 0,5 |
134 ± 0,5 |
0,3 |
17 |
13,0 -18,0 |
Chú thích: các ion thứ cấp có cường độ cao nhất được gạch chân.
6.2.6 Kiểm tra hiệu năng của hệ thống LC/MS/MS
Tiêm dung dịch chuẩn làm việc 1mg/l (5.5.4). Xác định tỷ lệ tín hiệu/nhiễu (S/N) đối với bước chuyển có cường độ thấp nhất. Tỷ lệ S/N phải lớn hơn 6. Lặp lại bước tiêm để kiểm tra sự lặp lại của thời gian lưu, diện tích pic và tỉ lệ các ion.
6.2.7 Trình tự tiêm mẫu
Các mẫu sẽ được phân tích theo trình tự sau:
a. Dung môi trắng;
b. Mẫu kiểm soát âm tính (6.1.2.1);
c. Mẫu kiểm soát dương tính (6.1.2.2);
d. Mẫu kiểm soát độ thu hồi (6.1.2.3);
đ. Dung môi trắng;
e. Mẫu cần kiểm nghiệm (6.2.4);
g. Dung môi trắng;
h. Mẫu kiểm soát âm tính (6.1.2.1);
i. Mẫu kiểm soát dương tính (6.1.2.2).
7 Tính kết quả
7.1 Tính tỉ số ion theo công thức sau:
|
R (%) = |
100 x A1 |
(1) |
|
A2 |
Trong đó:
– R là tỉ số ion (%).
– A1 là diện tích của pic ion thứ cấp có cường độ thấp nhất.
– A2 là diện tích của pic ion thứ cấp có cường độ cao nhất.
7.2 Tính độ lệch tương đối của tỉ số ion theo công thức sau:
|
∆R (%) = |
Rs – Rm |
x 100 (2) |
|
Rm |
Trong đó:
– ∆R là độ lệch tương đối giữa tỉ số ion của chất cần phân tích trong mẫu kiểm với tỉ số ion trung bình của chất đó trong mẫu kiểm soát dương tính có nồng độ 1 mg/kg và cao hơn (%).
– Rs là tỉ số ion của chất cần phân tích trong mẫu kiểm (1).
– Rm là tỉ số ion trung bình của chất cần phân tích trong mẫu kiểm soát dương tính có nồng độ 1 mg/kg và cao hơn (%) (1).
7.3 Tính thời gian lưu tương đối theo theo công thức sau:
|
Rrt |
Rt |
(3) |
|
RtIS |
Trong đó:
– Rrt là thời gian lưu tương đối.
– Rt là thời gian lưu của chất cần phân tích.
– RtIS là thời gian lưu của chất chuẩn nội (đối với NPSEM thì NPAHD-d2 là chất chuẩn nội).
7.4 Tính độ lệch chuẩn của thời gian lưu tương đối theo công thức sau:
|
∆Rrt (%) |
Rrts – Rrtm |
x 100 (4) |
|
Rrtm |
Trong đó:
– ∆Rrt là độ lệch tương đối giữa Rrt của chất cần phân tích trong mẫu kiểm so với Rrt của chất đó trong mẫu kiểm soát dương tính (%).
– Rrts là thời gian lưu tương đối của chất cần phân tích trong mẫu kiểm.
– Rrtm là thời gian lưu tương đối trung bình của chất cần phân tích trong mẫu kiểm soát dương tính.
7.5 Chất cần phân tích được khẳng định là có mặt khi các yêu cầu sau được thoả mãn:
a. Tỷ lệ tín hiệu/nhiễu cho mỗi ion phải không nhỏ hơn 3:1.
b. Mức dung sai tối đa cho phép của các cường độ ion tương đối, sử dụng nhiều loại kỹ thuật khối phổ theo qui định trong Bảng 4.
Bảng 4 – Mức dung sai tối đa cho phép của các cường độ ion tương đối
|
Cường độ tương đối (% của pic cơ sở) |
LC-MS, LC-MSn (tương đối) |
|
Lớn hơn 50 % |
± 20 % |
|
Từ lớn hơn 20 đến 50 % |
± 25 % |
|
Từ lớn hơn 10 đến 20 % |
± 30 % |
|
Không lớn hơn 10 % |
± 50 % |
7.6 Tính hệ số tín hiệu cho từng chất cần phân tích theo công thức sau:
|
RF = |
Sp |
(5) |
|
SpIS |
Trong đó:
– RF là hệ số tín hiệu.
– Sp là tổng diện tích pic của các ion thứ cấp của chất cần phân tích.
– SpIS làdiện tích pic của ion thứ cấp của chất chuẩn nội (đối với NPSEM, NPAHD-d2 được sử dụng làm chất chuẩn nội).
7.7 Tính lượng chất cần phân tích có mặt trong mẫu kiểm theo công thức sau:
|
X = |
RF – b |
|
|
a |
Trong đó:
– X là lượng chất cần phân tích có trong mẫu kiểm (mg/kg). (*)
– RF là hệ số tín hiệu (công thức 5).
– b là độ dựng của đường chuẩn tính theo phương pháp hồi qui tuyến tính.
– a là độ dốc của đường chuẩn tính theo phương pháp hồi qui tuyến tính. (**)
Chú thích: (*) : tính theo khối lượng chất chuyển hoá chưa bị dẫn xuất hoá.
(**): dựng đồ thị tín hiệu của mẫu kiểm soát dương tính với nồng độ chất chuẩn bổ sung và áp dụng hồi qui tuyến tính.
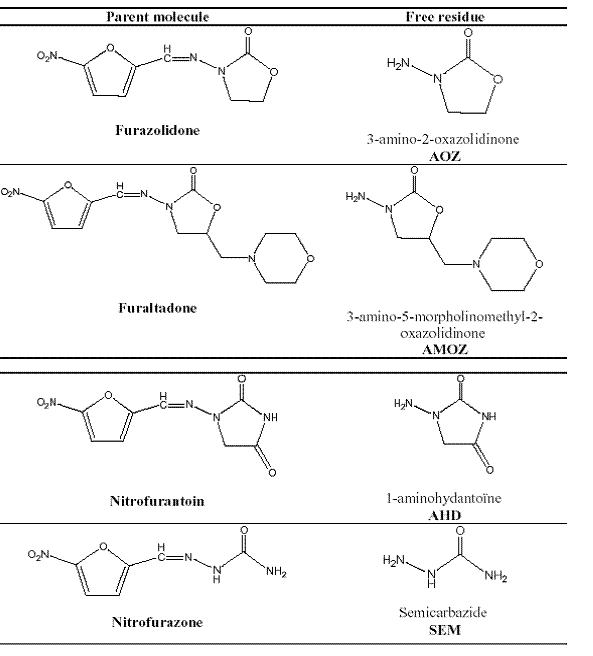
PHỤ LỤC A
(tham khảo)
SỰ CHUYỂN HOÁ CỦA CÁC CHẤT THUỘC NHÓM NITROFURAN
Dược chất Chất chuyển hóa