Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 8400-6:2011 về bệnh động vật – quy trình chẩn đoán – phần 6: bệnh xuất huyết thỏ do Bộ Nông nghiệp và Phát triển nông thôn ban hành
TCVN 8400-6:2011
BỆNH ĐỘNG VẬT – QUY TRÌNH CHẨN ĐOÁN – PHẦN 6: BỆNH XUẤT HUYẾT THỎ
Animal disease – Diagnostic procedure – Part 6: Rabbit haemorrhagic disease
CẢNH BÁO – Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Các phòng thí nghiệm sử dụng tiêu chuẩn này phải tự thiết lập các nguyên tắc bảo đảm an toàn sinh học để không phải bị nhiễm bệnh nghề nghiệp hoặc thất thoát các mầm bệnh từ phòng thí nghiệm ra môi trường.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh xuất huyết thỏ đối với thỏ ở mọi lứa tuổi.
2. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau:
Bệnh xuất huyết thỏ (Rabbit haemorrhagic disease)
Bệnh truyền nhiễm cấp tính do vi rút Calici thuộc họ Caliciviridae gây ra cho thỏ ở mọi lứa tuổi (đặc biệt đối với thỏ 2 tháng tuổi trở lên). Bệnh có biểu hiện là gây chết nhanh và xuất huyết nặng ở gan, khí quản, phổi,
3. Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và sử dụng nước cất hai lần hoặc nước đã được khử khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có quy định khác.
Xem Phụ lục A về mô tả tất cả các dung dịch thuốc thử.
– Cồn 70 %.
– Kháng huyết thanh chuẩn xuất huyết thỏ.
– Kháng nguyên chuẩn xuất huyết thỏ.
4. Thiết bị, dụng cụ và động vật thí nghiệm
4.1 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ thông thường của phòng thí nghiệm và cụ thể sau đây: – Tủ lạnh.
– Tủ ấm, có thể duy trì nhiệt độ 37oC, 5 % CO2.
– Cân phân tích.
– Tủ sấy, có thể duy trì nhiệt độ từ 1000C đến 2000C.
– Nồi hấp ướt.
– Nồi đun cách thủy.
– Buồng cấy.
– Máy ly tâm lạnh, tốc độ tối đa 3000 r/min.
– Máy ly tâm lạnh, tốc độ tối đa 12000 r/min.
– Máy khuấy từ, thanh khuấy từ.
– Máy lắc đĩa 96 giếng làm phản ứng ngưng kết.
– Micropipet đơn kênh cỡ từ 0,5 µl đến 10 µl, 1 µl đến 20 µl, 20 µl đến 200 µl, 100 µl đến 1000 µl.
– Micropipet đa kênh cỡ từ 5 µl đến 50 µl.
– Đầu tip phù hợp với các loại micropipet (có lọc và không có lọc).
– Đĩa phản ứng 96 giếng, đáy chữ U.
– Máy đọc ELISA.
– Bộ đồ mổ tiểu gia súc.
– Ống nghiệm vô trùng, dung tích 10 ml.
– Giá đựng ống nghiệm.
– Ống effendorf chắt huyết thanh, dung tích 1,5 ml.
– Ống effendorf, dung tích 0,2 ml.
– Ống hút Pasteur.
– Pipet khắc độ 1 ml, 5 ml, 10 ml.
– Pipet.
– Bơm tiêm loại 1 ml, 5 ml và kim tiêm.
– Lọ đựng bệnh phẩm 20 ml.
– Bộ cối chày sứ.
– Đĩa lồng Petri
– Panh, kéo cắt tổ chức bệnh phẩm.
– Đèn cồn hoặc đèn ga.
– Bình nón 100 ml, 250 ml, 500 ml, 1000 ml.
– Hộp nhuộm tiêu bản.
–Hộp giữ ẩm cho lam kính.
– Giấy nhôm bao gói.
– Bộ micropipet và đầu hút.
– Bông cồn.
– Giấy dán nhãn.
– Bút dạ ghi nhãn.
– Bút chì mỡ ghi lam kính.
4.2 Động vật thí nghiệm
Chuẩn bị thỏ 3 tháng tuổi khỏe mạnh, không bị bệnh.
5. Cách tiến hành
5.1 Chẩn đoán lâm sàng
5.1.1 Đặc điểm dịch tễ
Bệnh xuất huyết thỏ lây truyền do tiếp xúc trực tiếp giữa thỏ khỏe mạnh và thỏ bị nhiễm bệnh qua các chất bài tiết, chất thải như phân, nước tiểu, thức ăn và các vật dụng nuôi nhốt, quần áo…
Vi rút xuất huyết thỏ lây truyền qua không khí.
Thỏ bị bệnh có tỷ lệ chết cao từ 80 % đến 100 %.
Thỏ bệnh trở thành vật mang trùng và có thể đào thải vi rút ra ngoài môi trường trong vòng 4 tuần sau khi khỏi bệnh.
5.1.2 Triệu chứng lâm sàng
Bệnh xuất huyết thỏ có thời gian ủ bệnh từ 1 ngày đến 3 ngày.
Thỏ non thường cảm nhiễm với bệnh mạnh nhất, thỏ bị bệnh sẽ chết đột ngột hàng loạt trong vòng 6 h đến 24 h mà không biểu hiện triệu chứng.
Đối với thỏ mắc bệnh, lúc đầu có biểu hiện sốt cao (40,50C) nhưng khó phát hiện, chỉ khi thỏ có các triệu chứng thì mới nhận ra được thỏ bệnh.
Thỏ mắc bệnh có biểu hiện chán ăn, đờ đẫn, co giật, khó thở, ít vận động, chảy máu mũi và thường bị chết sau 18 h đến 40 h.
5.1.3 Bệnh tích
5.1.3.1 Lấy mẫu
Lấy vô trùng gan, thận thỏ nghi mắc bệnh để kiểm tra bệnh tích đại thể, vi thể. Bảo quản và xử lí mẫu theo 5.2.1.
5.1.3.2 Bệnh tích đại thể
– Tổ chức dưới da bị xuất huyết điểm.
– Gan, thận, lách của thỏ bệnh sưng to, xung huyết, xuất huyết.
– Hệ hô hấp xung huyết, xuất huyết và chứa nhiều bọt khí, dịch nhầy.
– Viêm dạ dày cata, viêm ruột xuất huyết, hạch màng treo ruột sưng to.
5.1.3.3 Bệnh tích vi thể
Các tế bào gan hoại tử, trong phế nang và tiểu cầu thận có nhiều cục huyết khối.
5.2 Chẩn đoán phòng thí nghiệm
5.2.1 Lấy mẫu
Lấy vô trùng gan, thận thỏ nghi mắc bệnh để phát hiện kháng nguyên.
Mẫu bệnh phẩm là huyết thanh chẩn đoán thỏ mắc bệnh được lấy sau khi thỏ có triệu chứng lâm sàng tối thiểu là 10 ngày trở đi đối với thỏ chưa được tiêm phòng bệnh xuất huyết thỏ, hoặc sau từ 3 tuần đến 4 tuần đối với thỏ đã tiêm phòng bệnh xuất huyết thỏ để phát hiện kháng thể. Lấy từ 5 mẫu đến 10 mẫu huyết thanh.
Mẫu được lấy ngay sau khi mổ khám, đựng vào lọ hoặc túi nilon sạch có dán nhãn có ghi ngày lấy mẫu, địa điểm lấy mẫu, chủ vật nuôi, lứa tuổi.
Mẫu được bảo quản ở nhiệt độ từ 4 0C đến 8 0C và gửi đến phòng xét nghiệm càng sớm càng tốt, chậm nhất là 48 h và có kèm theo phiếu gửi bệnh phẩm.
5.2.2 Phát hiện kháng nguyên
5.2.2.1 Xử lý bệnh phẩm
Cho dung dịch PBS pH 6,4 vào cối sứ có gan hoặc thận thỏ nghi mắc bệnh với tỷ lệ 9:1.
Nghiền nát gan hoặc thận thành huyễn dịch 1/10, ly tâm huyễn dịch với tốc độ 3000 g trong thời gian 30 min.
Thu dịch nổi, xử lý vô trùng bằng dung dịch kháng sinh đậm đặc (Phụ lục A) liều lượng 0,1 ml /10 ml huyễn dịch, để ở nhiệt độ phòng trong 30 min hoặc lọc qua màng lọc có đường kính 0,45 m. Huyễn dịch bệnh phẩm đã xử lý dùng để chẩn đoán phát hiện vi rút bằng các phản ứng HA, HI, phân lập vi rút trên bản động vật hoặc phản ứng RT-PCR (Phụ lục D), ELISA.
5.2.2.2 Phản ứng ngưng kết hồng cầu người typ O (xem Phụ lục B)
Phản ứng ngưng kết hồng cầu (phản ứng HA) dùng phát hiện vi rút trong mẫu bệnh phẩm, cho huyễn dịch đã xử lý kết hợp với hồng cầu người typ O 0,75 % trên đĩa nhựa chữ U và dung dịch đệm PBS có pH 6,4.
Vi rút xuất huyết thỏ làm ngưng kết hồng cầu người typ O.
Phản ứng ngưng kết xảy ra ở độ pha loãng lớn hơn hoặc bằng 1/160 được kết luận là dương tính.
5.2.2.3 Phản ứng ngăn trở ngưng kết hồng cầu người typ O (xem Phụ lục C)
Phản ứng ngăn trở ngưng kết hồng cầu (phản ứng HI) dùng để giám định vi rút xuất huyết thỏ hoặc kiểm tra kháng thể kháng vi rút xuất huyết thỏ trong huyết thanh.
Chuẩn bị kháng nguyên: Huyễn dịch bệnh phẩm dương tính theo 5.2.2.2 được pha 8 đơn vị HA.
Thực hiện phản ứng HI với hồng cầu người 2,5 % và dung dịch đệm phosphat pH 6,4. Đọc kết quả sau 1 h.
– Mẫu dương tính: có ngăn trở ngưng kết hồng cầu (thường đạt hiệu giá từ 1/20 đến 1/80). – Mẫu âm tính: không có ngăn trở ngưng kết hồng cầu.
5.2.2.4 Phân lập vi rút
5.2.2.4.1 Cách tiến hành
Tiêm bắp huyễn dịch bệnh phẩm cho 3 thỏ, mỗi con với liều 1 ml huyễn dịch. Theo dõi triệu chứng, bệnh tích thỏ được tiêm bệnh phẩm trong vòng 5 ngày đến 7 ngày.
Nếu bệnh phẩm có vi rút, thỏ sẽ có triệu chứng lâm sàng như miêu tả trong 5.1.2, thỏ chết mổ khám sẽ thấy bệnh tích giống như miêu tả trong 5.1.3. Sau đó thu hoạch gan, thận và xử lý theo 5.2.2.1.
Làm phản ứng ngưng kết hồng cầu người typ O (Phụ lục C) và giám định vi rút các mẫu dương tính HA bằng phản ứng ngăn trở ngưng kết hồng cầu typ O với kháng thể kháng vi rút xuất huyết thỏ chuẩn như trong 5.2.2.3 để kết kuận.
5.2.2.4.2 Đánh giá kết quả
– Nếu phản ứng HA và HI dương tính, có vi rút xuất huyết thỏ trong bệnh phẩm.
– Nếu kết quả HA dương tính và HI âm tính, có thể có vi rút xuất huyết thỏ nhưng lượng vi rút ít nên tiếp tục phân lập lần 2 lặp lại như mô tả (5.2.2.4.1).
– Nếu kết quả HA âm tính và HI âm tính, kết luận trong mẫu bệnh phẩm không có vi rút xuất huyết thỏ.
5.2.2.5 Phát hiện kháng nguyên bằng phương pháp ELISA
Sử dụng huyễn dịch bệnh phẩm (5.2.2.1) hoặc huyết thanh của thỏ ốm để tiến hành thực hiện phản ứng. Khi sử dụng kít ELISA, thực hiện theo hướng dẫn của nhà sản xuất.
5.2.2.6 Phát hiện kháng nguyên bằng phương pháp PCR
Sử dụng huyễn dịch bệnh phẩm (5.2.2.1), tiến hành chiết tách RNA và nhân gen để chẩn đoán sự có mặt của vi rút. Khi sử dụng kít chiết tách và nhận gen, thực hiện theo hướng dẫn của nhà sản xuất.
5.2.3 Phát hiện kháng thể
5.2.3.1 Nguyên tắc
Sử dụng huyết thanh của thỏ ốm để chẩn đoán bệnh xuất huyết thỏ khi chưa tiêm phòng, hoặc nhiễm vi rút xuất huyết thỏ từ trước đó. Cũng có thể kiểm tra hiệu giá kháng thể sau tiêm phòng vacxin xuất huyết thỏ.
5.2.3.2 Phản ứng ngăn trở ngưng kết hồng cầu người nhóm O
a) Xử lý huyết thanh làm HI để phát hiện kháng thể xuất huyết thỏ:
– Vô hoạt bổ thể ở 56 0C trong 30 min.
– Xử lý với dung dịch kaolin 25 % (Phụ lục A) trong 20 min ở nhiệt độ phòng theo tỷ lệ 1 phần huyết thanh với 9 phần dung dịch kaolin 25 %, ly tâm 1500g trong 10 min sau đó thu dịch nổi.
– Xử lý với hồng cầu người typ O: Cho 1 phần hồng cầu người typ O đậm độ 50 % và 9 phần dịch nổi ở trên. Lắc đều để ở nhiệt độ phòng trong 20 min, ly tâm 1500g trong 10 min, thu dịch nổi để làm HI. Huyết thanh đã xử lý có hiệu giá ban đầu là 1/10.
b) Tiến hành phản ứng HI (xem Phụ lục C)
– Phát hiện kháng thể Xuất huyết thỏ bằng phản ứng ngăn trở ngưng kết hồng cầu người typ O với kháng nguyên chuẩn xuất huyết thỏ,
– Hiệu giá kháng thể được tính ở độ pha loãng huyết thanh cao nhất còn có hiện tượng ngăn trở ngưng kết hồng cầu.
– Mẫu huyết thanh có hiệu giá lớn hơn hoặc bằng 1/80 được đánh giá là dương tính đối với thỏ nghi bệnh chưa tiêm phòng,
5.2.3.3 Phương pháp ELISA phát hiện kháng thể
Sử dụng mẫu bệnh phẩm là huyết thanh của thỏ ốm.
Khi sử dụng kít ELISA, thực hiện theo hướng dẫn của nhà sản xuất.
6. Kết luận
Thỏ được xác định mắc bệnh xuất huyết thỏ khi có các đặc điểm dịch tễ học, triệu chứng lâm sàng, giải phẫu bệnh tích của bệnh xuất huyết thỏ và kết quả dương tính với một trong những phương pháp sau:
– Phản ứng ngưng kết hồng cầu người typ O (HA) và phản ứng ngăn trở hồng cầu người typ O (HI) dương tính hoặc phản ứng RT-PCR hoặc rRT-PCR dương tính.
– Phát hiện thấy kháng thể trong trường hợp chưa tiêm vacxin xuất huyết thỏ.
PHỤ LỤC A
(Quy định)
THÀNH PHẦN VÀ CHUẨN BỊ DUNG DỊCH THUỐC THỬ
A.1 Dung dịch kháng sinh đậm đặc
Penicillin 106 IU
Streptomycin 1 g
Mycostatin x 105 U
Polymixin 15 x 104 U
Kanamycin 1 g
Nước 10 ml
Lắc đều cho tan, lọc vô trùng bằng màng lọc cỡ 0,45 µl và bảo quản ở âm 20 0C.
A.2 Dung dịch muối đệm phosphat (PBS) pH 7,2
Natri clorua (NaCl) 8,5 g
Dinatri hydrophosphat (Na2HPO4) 1,15 g
Kali dihydrophosphat (KH2PO4) 0,2 g
Kali clorua (KCl) 0,2 g
Nước 1000 ml
Chỉnh pH bằng dung dịch NaOH 1 N hoặc dung dịch HCl 1 N. Hấp vô trùng ở 121 0C trong 30 min.
Giữ trong tủ mát ở 4 0C đến 8 0C trong 2 tuần.
A.3 Dung dịch PBS pH 6,4
NaCl 8,5 g
Na2HPO4 2,53 g
KH2PO4 6,66 g
Nước 1000 ml
Chỉnh pH bằng dung dịch NaOH 1 N hoặc dung dịch HCl 1 N. Hấp vô trùng ở 121 0C trong 30 min.
Giữ trong tủ mát ở 4 0C đến 8 0C trong 2 tuần.
A.4 Dung dịch PBS pH 9,0
Axit boric 3,092 g
NaOH 0,96 g
NaCl 7,012 g
Nước 1200 ml
Hấp vô trùng ở 121 0C trong 30 min.
Giữ trong tủ mát ở 4 0C đến 8 0C trong 3 tháng.
A.5 Dung dịch hồng cầu người typ O 0,75 %
Hồng cầu người typ O rửa sạch: 0,75 ml
Dung dịch PBS pH 6,4: 100 ml
Lắc đều, giữ trong tủ mát ở 4 0C đến 8 0C. Pha dùng trong ngày.
A.6 Dung dịch hồng cầu người typ O 2,5 %
Hồng cầu người typ O rửa sạch: 2,5 ml
Dung dịch PBS pH 6,4: 100 ml
Lắc đều, giữ trong tủ mát ở 4 0C đến 8 0C. Pha dùng trong ngày.
A.7 Dung dịch kaolin 25 %
Bột kaolin 10 g
Dung dịch PBS pH 9,0 40 ml
Lắc đều, giữ trong tủ mát ở 4 0C đến 8 0C trong 3 tháng.
PHỤ LỤC B
(Quy định)
KỸ THUẬT LÀM PHẢN ỨNG NGƯNG KẾT HỒNG CẦU NGƯỜI TYP O
B.1 Nguyên liệu
– Hồng cầu người typ O 0,75 % (A.5)
– Huyễn dịch bệnh phẩm 10 % trong PBS pH 6,4 (hoặc kháng nguyên chuẩn xuất huyết thỏ) – Dung dịch PBS pH 6,4 (A.3)
B.2 Trình tự tiến hành phản ứng
Dùng đĩa ngưng kết 96 giếng, đáy chữ U
Cho 25 ml PBS pH 6,4 từ giếng 1 đến giếng 12.
Cho 25 ml huyễn dịch bệnh phẩm đã xử lý 10 % trong PBS hoặc kháng nguyên chuẩn vào giếng 1.
Pha loãng kháng nguyên: Trộn đều huyễn dịch hoặc kháng nguyên với PBS ở giếng 1, hút 25 ml chuyển sang giếng 2 trộn đều, hút 25 ml chuyển sang giếng 3 trộn đều, tiếp tục làm như vậy đến giếng 11, hút bỏ 25 ml ở giếng 11. Giếng 12 chỉ có PBS để làm đối chứng hồng cầu.
Cho hồng cầu người 0,75 % vào mỗi giếng 25 ml, lắc nhẹ trên máy lắc 1 min. Để đĩa phản ứng ở nhiệt độ phòng. Đọc kết quả sau 30 min đến 60 min.
– Phản ứng dương tính: Có hạt ngưng kết lấm chấm.
– Phản ứng âm tính: Hồng cầu lắng xuống đáy tạo thành chấm tròn.
Hiệu giá ngưng kết HA được tính ở độ pha loãng kháng nguyên cao nhất còn xuất hiện ngưng kết hoàn toàn. Ví dụ: giếng cuối cùng còn có ngưng kết hoàn toàn ở cột 8, hiệu giá HA = 1/256 (hay 8 log2).
|
Các bước |
Nguyên liệu |
Giếng |
|||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
||
|
Pha loãng kháng nguyên xuất 25 ml. huyết thỏ |
PBS, ml |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
|
|
Kháng nguyên huyễn dịch bệnh phẩmml |
25 |
Trộn đều, chuyển 25 ml lần lượt từ giếng 1 đến giếng 11 rồi hút bỏ 25 ml. dịch bệnh |
||||||||||
|
|
Hồng cầu 0,75 %, ml |
|
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
|
Cho hồng cầu người typ O |
Độ pha loãng kháng nguyên |
1/2 |
1/4 |
1/8 |
1/18 |
1/32 |
1/64 |
1/128 |
1/256 |
1/512 |
1/1024 |
1/2048 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B.3 Nhận định kết quả
– Nếu HA dương tính: Kết luận có vi rút gây bệnh. Để xác định là vi rút xuất huyết thỏ cần phải làm phản ứng HI với kháng huyết thanh dương tính chuẩn xuất huyết thỏ.
– Nếu phản ứng HA âm tính: Có thể trong bệnh phẩm không có mặt vi rút xuất huyết thỏ hoặc lượng vi rút quá ít. Vì vậy, cần tiêm truyền bệnh phẩm trên thỏ 3 tháng tuổi không có kháng thể kháng vi rút gây bệnh xuất huyết thỏ và giám định lại bằng phương pháp HA, HI.
PHỤ LỤC C
(Quy định)
KỸ THUẬT LÀM PHẢN ỨNG NGĂN TRỞ NGƯNG KẾT HỒNG CẦU NGƯỜI TYP O
C.1 Chuẩn bị
– Dung dịch PBS pH 6, 4 (A.3)
– Hồng cầu người typ O 2,5 % (A.6)
– Huyết thanh kiểm tra (hoặc kháng huyết thanh chuẩn xuất huyết thỏ) được xử lý theo 5.2.3.1.
– Kháng nguyên chuẩn (hoặc huyễn dịch bệnh phẩm cần kiểm tra xuất huyết thỏ)
– Kháng nguyên dùng cho phản ứng HI được pha 8 đơn vị HA.
C.2 Cách pha và chuẩn độ kháng nguyên 8 đơn vị HA
VÍ DỤ: Hiệu giá kháng nguyên trong phản ứng HA là 1/256 thì 8 HA bằng 1/256 x 8 = 1/32 Pha 8 HA gồm 1 phần kháng nguyên và 31 phần PBS pH 6,4.
Chuẩn độ kháng nguyên 8 HA đã pha bằng phản ứng HA. Nếu kết quả ngưng kết đến giếng thứ 3, như vậy kháng nguyên pha đạt. Nếu ngưng kết đến giếng thứ 4 (hoặc hơn) là kháng nguyên pha đặc. Nếu ngưng kết chỉ ở giếng đầu tiên hoặc giềng thứ 2 là kháng nguyên pha loãng. Dựa vào kết quả đó để bổ xung thêm kháng nguyên hoặc PBS để có kháng nguyên 8 HA chuẩn.
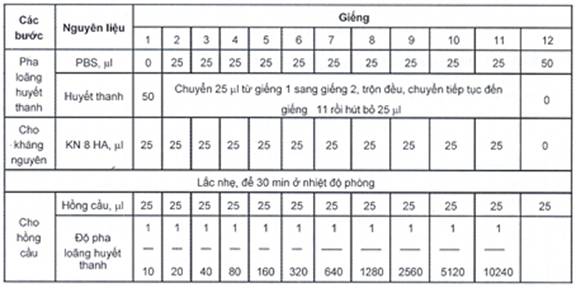
C.3 Cách tiến hành phản ứng
Dùng đĩa ngưng kết 96 giếng, đáy chữ U.
Cho PBS vào mỗi giếng 25 ml từ giếng 2 đến giếng 12.
Cho 50 ml huyết thanh cần kiểm tra vào giếng 1. Hút 25 ml từ giếng 1 chuyển sang giếng 2.
Pha loãng huyết thanh: Trộn đều huyết thanh với PBS ở giếng 2, rồi hút 25 ml chuyển sang giếng 3 trộn đều, hút 25 ml chuyển sang giếng 4 tiếp tục làm như vậy đến giếng 11, hút bỏ 25 ml ở giếng 11 đi.
Cho 25 ml kháng nguyên 8 đơn vị HA vào các giếng từ 1 đến 11. Giếng 12 cho thêm 25 ml PBS. Lắc nhẹ trên máy lắc sau đó để đĩa ở nhiệt độ phòng 30 min.
Cho hồng cầu người typ O 2,5 %: mỗi giếng 25 ml, lắc nhẹ 1 min. Để đĩa phản ứng ở nhiệt độ phòng. Đọc kết quả sau 30 min đến 60 min.
Mỗi đĩa phản ứng phải có mẫu đối chứng kháng nguyên chuẩn hoặc kháng thể chuẩn làm tương tự như mẫu cần chẩn đoán để đảm bảo 8 HA trong 25 ml đã được sử dụng cho phản ứng là đúng, mục đích là để kiểm soát mẫu huyết thanh và mẫu bệnh phẩm khi làm phản ứng.
C.4 Đọc kết quả
– Phản ứng dương tính: Hồng cầu lắng xuống đáy, chứng tỏ kháng nguyên và kháng thể tương ứng.
Hiệu giá kháng thể được tính ở độ pha loãng cao nhất còn có hiện tượng ức chế ngưng kết hoàn toàn.
– Phản ứng âm tính: Có hạt ngưng kết lấm tấm. Chứng tỏ không có sự kết hợp giữa kháng nguyên và kháng thể trong phản ứng.
C.5 Đánh giá kết quả
Mẫu là huyết thanh kiểm tra kháng thể: Những thỏ chưa được chủng vắc xin có kháng thể lớn hơn hoặc bằng 1/80 thì mẫu đó được coi là nhiễm vi rút xuất huyết thỏ.
Mẫu là kháng nguyên (huyễn dịch bệnh phẩm, huyễn dịch sau phân lập):
– Nếu có hiện tượng ức chế ngưng kết với kháng huyết thanh xuất huyết thỏ chuẩn thì vi rút phân lập được là vi rút xuất huyết thỏ.
– Nếu không có hiện tượng ức chế ngưng kết, mà HA dương tính cần phân lập tiếp trên thỏ.
PHỤ LỤC D
(Quy định)
KỸ THUẬT LÀM PHẢN ỨNG RT-PCR
D.1 Chiết tách RNA
Rneasy Extraction cat # 74104 50 prep hoặc # 74106 250 prep theo quy trình dưới đây.ÒDùng huyễn dịch đã xử lý theo 5.2.2.1 để chiết tách RNA. Có thể sử dụng bộ kít Qiagen
– ME, lắc đều trên máy Vortex rồi ly tâm nhẹ.b buffer RLT có 1 % Òl Qiagenml dịch nghiền mô vào ống ly tâm loại 1,5 ml cùng với 600 mNhỏ 200
l cồn 70 % vào ống, lắc mạnh bằng máy Vortex rồi ly tâm nhẹ;mThêm 500
Qiagen, ly tâm trong 15 s gia tốc ≥ 8000g ở nhiệt độ phòng;ÒChuyển tất cả dịch nổi sang cột lọc RNeasy
Qiagen, ly tâm trong 15 s ở tốc độ ≥ 8000g, thay ống thu mới vào cột lọc;Òl dung dịch rửa 1 (RW1 buffer) vào cột RNeasymBổ sung 700
và ly tâm trong 15 s ở gia tốc ≥ 8000g, thay ống thu mới, lặp lại 2 lần với dung dịch rửa RPE buffer;Òl dung dịch rửa RPE buffer vào cột RNeasymNhỏ 500
Thay ống thu mới, ly tâm cột lọc và ống thu trong 2 min ở tốc độ tối đa, bỏ ống thu;
l nước không chứa RNase vào cột lọc, ủ ở nhiệt độ phòng trong ít nhất 1 min. Tách RNA bằng cách ly tâm trong 1 min ở gia tốc ≥ 8000g, bỏ cột lọc, giữ lại dung dịch trong ống thu RNA;mĐặt cột lọc vào ống thu RNA, nhỏ 50
Bảo quản mẫu RNA thu được ở 4 0C trong thời gian ngắn trước khi làm RT-PCR, nếu sau 24 h, nên bảo quản mẫu ở âm 20 0C hoặc nhiệt độ thấp hơn.
D.2 Cách tiến hành
D.2.1 Chuẩn bị cặp mồi
Cặp mồi được thiết kế dựa trên đoạn gen mã hóa protein bám gắn của vi rút để khuếch đại một sản phẩm có kích thước 269 bp. Cặp mồi có trình tự như sau:
|
Cặp mồi |
Trình tự |
|
Mồi xuôi |
5’-d CAGCCGTACTGAGCCAGATGTA -3’ |
|
Mồi ngược |
5’-d AAGGACTAGTGGGAACAAGG- 3’ |
Cặp mồi này được sử dụng ở nồng độ 10 µM
D.2.2 Thực hiện phản ứng PCR
Pha hỗn hợp phản ứng (hỗn hợp mẹ).
VÍ DỤ: Sử dụng kít Platinium Quantitative PCR Superscript II của hãng Invitrogen, Co., USA.
|
Hỗn hợp mẹ |
Lượng cho 01 phản ứng, µl |
|
Nước cất siêu sạch không có men Nuclease |
9,5 |
|
Superscript II reverse transcriptase mix |
12,5 |
|
Mồi xuôi |
1 |
|
Mồi ngược |
1 |
|
Mẫu RNA |
1 |
|
Tổng lượng |
20,0 |
Để tính lượng hỗn hợp phản ứng cho nhiều phản ứng, lấy lượng nguyên liệu cho một phản ứng nhân với tổng số mẫu và các đối chứng.
Sau khi pha hỗn hợp phản ứng, chia 20 µl hỗn hợp mẹ vào các ống PCR, sau đó cho 5 µl RNA mẫu và đối chứng vào các ống thích hợp, ly tâm nhanh, rồi đặt ống PCR vào máy PCR.
Chạy phản ứng theo chu trình nhiệt như sau:
|
Chu trình 1 |
Chu trình 2 |
Chu trình 3 |
|
42 oC, 2 min; |
30 x (94 oC,1 min; 56 oC, 45 s; 72 oC, 50 s) |
72 oC,10 min; |
|
94 oC,10 min |
Giữ ở 4 oC |
D.2.3 Điện di và hiển thị sản phẩm PCR
Pha 1,2 g bột agarose (gel) với 100 ml 1xTAE, rồi đun nóng trong lò vi sóng cho đến khi tan hoàn toàn. Khi hỗn hợp nguội bớt có thể chạm tay vào, cho tiếp 2 µl etidi bromua (10 mg/ml) vào. Sau đó đổ gel vào khay gel và cắm lược. Để gel cứng lại trong khoảng 1 h, rồi rút lược ra.
Đổ đầy dung dịch 1xTAE vào bể điện di (đến vạch full level), đặt khay gel vào vị trí trong bể điện di. Pha 2 ul loading dye với 4 µl 100 bp lader rồi đưa vào giếng đầu tiên của miếng Gel. Pha 2 µl loading dye vơi 8 µl mẫu (đối chứng âm và dương) rồi đưa vào các giếng còn lại của miếng Gel.
Điện di gel ở 80 V đến 100 V trong 30 min đến 40 min.
D.3 Đọc kết quả
Đặt gel đã điện di vào máy chiếu UV (UV transilluminator) có bước sóng 590 nm. Các mẫu có hiển thị band sản phẩm kích thước 269 bp là dương tính.
Phụ lục E
(Quy định)
Kỹ thuật làm phản ứng rRT-PCR
E.1 Chiết tách RNA
Xem Phụ lục D.
E.2 Cách tiến hành
E.2.1 Chuẩn bị cặp mồi
Các mồi xuôi và mồi ngược và mẫu dò được thiết kế đặc hiệu để phát hiện gen RNA pol của vi rút Calici thuộc họ Caliciviridae.
|
Cặp mồi |
Trình tự |
|
Mồi xuôi |
5’-d ACYTYACTAAACTYATTGACG -3’ |
|
Mồi ngược |
5’-d TCAGACATAAGAAAAGAAATTGG- 3’ |
|
Mẫu dò |
FAM – CCAARAGCACRCTCGTGTTCAACCT- TAMRA |
Cặp mồi này được sử dụng ở nồng độ 10 µM
Công thức pha hỗn hợp mẹ (master mix) có thể thay đổi cho phù hợp với từng loại cặp mồi và từng loại kít rRT-PCR khác nhau. Dưới đây quy trình giới thiệu 1 bộ kit.
Công thức áp dụng cho kít RT-PCR của hãng Invitrogen
|
Hỗn hợp mẹ |
Lượng cho 01 phản ứng, µl |
|
Nước |
5,5 |
|
2X Reaction buffer |
12,5 |
|
Enzym mix |
0,5 |
|
Mồi xuôi |
0,5 |
|
Mồi ngược |
0,5 |
|
Mẫu dò |
0,5 |
|
Mẫu RNA |
5 |
|
Tổng cộng |
25 l |
E.2.2 Thực hiện phản ứng PCR
Đặt ống phản ứng vào máy chu kỳ nhiệt và chọn chương trình chạy PCR bằng phần mềm trên máy vi tính. Nhập ký hiệu mẫu kiểm tra cùng với mẫu đối chứng dương tính, âm tính vào phần Ký hiệu mẫu trong bảng kết quả. Lưu chương trình chạy máy. Cài đặt chương trình phân tích dữ liệu cho máy chu kỳ nhiệt (ví dụ: máy Cepheid Smart Cycler hoặc Biorad IQ5) và chạy chương trình.
Chạy phản ứng theo chu trình nhiệt như sau:
|
Chu trình 1 |
Chu trình 2 |
Chu trình 3 |
|
50oC, 30 min; |
45 x (94oC, 3 s; 55oC, 45 s) |
68oC, 45 s; |
|
94oC, 2 min |
Giữ ở 4oC |
E.3 Phân tích kết quả
Các giá trị mặc định đã được thiết lập trong chương trình chạy của máy Realtime RT-PCR để phát hiện vi rút xuất huyết thỏ. Mẫu đối chứng dương tính (được chuẩn độ trước) phải có giá trị Ct như đã biết (± 2 Ct) và mẫu đối chứng âm tính phải có Ct = 0 thì kết quả rRT-PCR mới được công nhận.
Mẫu có giá trị Ct ≤ 35 được coi là dương tính. Mẫu không có Ct được coi là âm tính. Mẫu có giá trị Ct trong khoảng từ 35 đến 40 được coi là nghi ngờ. Những mẫu nghi ngờ này cần được xác chẩn bằng phương pháp phân lập vi rút trước khi có kết luận chẩn đoán cuối cùng.


