Nội dung toàn văn Tiêu chuẩn quốc gia TCVN 8901:2011 (EN 1137:1994) về Nước rau quả – Xác định hàm lượng axit xitric (xitrat) bằng enzym – Phương pháp đo phổ NADH
TIÊU CHUẨN QUỐC GIA
TCVN 8901:2011
EN 1137:1994
NƯỚC RAU QUẢ – XÁC ĐỊNH HÀM LƯỢNG AXIT XITRIC (XITRAT) BẰNG ENZYM – PHƯƠNG PHÁP ĐO PHỔ NADH
Fruit and vegetable juices – Enzymatic determination of citric acid (citrate) content – NADH spectrometric method
Lời nói đầu
TCVN 8901:2011 hoàn toàn tương đương với EN 1137:1994;
TCVN 8901:2011 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F10 Rau quả và sản phẩm rau quả biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
NƯỚC RAU QUẢ – XÁC ĐỊNH HÀM LƯỢNG AXIT XITRIC (XITRAT) BẰNG ENZYM – PHƯƠNG PHÁP ĐO PHỔ NADH
Fruit and vegetable juices – Enzymatic determination of citric acid (citrate) content – NADH spectrometric method
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp enzym để xác định hàm lượng axit xitric tổng số trong nước rau quả và các sản phẩm có liên quan, ở dạng axit tự do hoặc dạng muối xitrat.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987), Nước dùng để phân tích trong phòng thí nghiệm – Yêu cầu kĩ thuật và phương pháp thử.
ISO 5725:1986* Precision of test methods – Determination of repeatability and reproducibility for a standard test method by inter-laboratory tests (Độ chụm của phương pháp thử – Xác định độ lặp lại và độ tái lập của phương pháp thử bằng thử nghiệm liên phòng).
3. Kí hiệu và chữ viết tắt
Trong tiêu chuẩn này sử dụng các kí hiệu và chữ viết tắt sau:
|
NAD |
b-Nicotinamit-adenin-dinucleotit; |
|
NADH |
b-Nicotinamit-adenin-dinucleotit, dạng khử; |
|
CL |
Xitrat lyaza (EC1) 4.1.3.6); |
|
MDH |
Malat dehydrogenaza (EC1) 1.1.1.37); |
|
LDH |
Lactat dehydrogenaza (EC1) 1.1.1.27); |
|
IU |
1 đơn vị quốc tế (IU) hoạt độ enzym xúc tác chuyển đổi được 1 µmol cơ chất mỗi phút ở 25 oC trong điều kiện chuẩn; |
|
c |
Nồng độ chất; |
|
r |
Nồng độ khối lượng. |
4. Nguyên tắc
Phương pháp này dựa trên sự chuyển hóa xitrat thành oxaloaxetat bằng enzym. Pyruvat được tạo thành từ phản ứng khử cacbon của oxaloaxetat. Sau đó, enzym khử cả oxaloaxetat và pyruvat về dạng khử nicotinamit adenin dinucleotit, tiếp theo tiến hành đo phổ. Hàm lượng axit xitric tương đương với hàm lượng tổng số của NADH được đo theo mức độ giảm độ hấp thụ.
4.1. Phản ứng
Các phản ứng enzym sau đây xảy ra tại pH = 7,8:
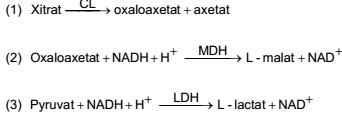
5. Thuốc thử
5.1. Yêu cầu chung
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và nước loại 3 nêu trong TCVN 4851:1989 (ISO 3696:1987).
5.2. Đệm glyxylglyxin, pH 7,8
Hòa tan 7,13 g glyxylglyxin trong 70 ml nước, chỉnh đến pH 7,8 bằng khoảng 13 ml natri hydroxit [c(NaOH) = 5 mol/l], thêm 10 ml dung dịch kẽm clorua, ρ(ZnCl2) = 0,8 g/l và pha loãng bằng nước đến 100 ml. Dung dịch đệm đã pha bền được ít nhất bốn tuần ở + 4 oC.
5.3. Dung dịch NADH
Hòa tan 30 mg muối dinatri của b-nicotinamit-adenin-dinucleotit dạng khử (b-NADH-Na2) và 60 mg natri hydrocacbonat (NaHCO3) trong 6 ml nước. Dung dịch đã pha bền được ít nhất bốn tuần ở + 4 oC.
5.4. Huyền phù enzym MDL/LDH
Trộn 0,1 ml malat dehydrogenaza, r(MDH) = 5 mg/ml, khoảng 6000 IU/ml với cơ chất là oxaloaxetat, 0,4 ml dung dịch amoni sulfat c[(NH4)2SO4] = 3,2 mol/l và 0,5 ml lactat dehydrogenaza, r(LDH) = 5 mg/ml, khoảng 2750 IU/ml với cơ chất là pyruvat. Huyền phù đã pha bền được ít nhất một năm ở + 4 oC.
5.5. Huyền phù enzym CL
Hòa tan 168 mg lyophilisat (5 mg enzym protein) của xitrat lyaza (khoảng 1,25 IU/ml với cơ chất là xitrat) trong 1 ml nước đá lạnh. Huyền phù đã pha bền được ít nhất một tuần ở + 4 oC và trong ít nhất bốn tuần ở trạng thái đông lạnh.
6. Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
6.1. Pipet dùng để thử nghiệm enzym, có chia vạch dọc thân pipet và đầu tip phân phối dài, không chia vạch.
6.2. Pipet, có độ chính xác tương đương với 6.1 (thay thế cho 6.1), ví dụ có thể thay đổi dung tích pipet.
6.3. Cuvet, làm bằng thủy tinh hoặc bằng nhựa, có chiều dài đường quang 10 mm và có độ hấp thụ không đáng kể ở các bước sóng 334 nm, 340 nm hoặc 365 nm.
6.4. Máy đo quang đơn phổ, có đèn thủy ngân và màng lọc đo được ở các bước sóng 334 nm hoặc 365 nm.
6.5. Máy đo quang phổ, (bước sóng có thể thay đổi) để đo ở 340 nm (thay thế cho 6.4).
7. Cách tiến hành
7.1. Chuẩn bị mẫu thử
Đối với các sản phẩm thông thường, không xử lí trước và việc phân tích theo phương pháp này phải thực hiện dựa vào đơn vị thể tích, kết quả được biểu thị theo lít mẫu thử. Việc phân tích các sản phẩm cô đặc có thể thực hiện dựa theo thể tích sau khi pha loãng đến tỉ trọng tương đối đã biết. Trong trường hợp này, phải đưa ra được tỉ trọng tương đối. Dựa trên lượng mẫu đã cân và đưa hệ số pha loãng khi phân tích vào phép tính, kết quả có thể được biểu thị theo kilogam sản phẩm. Đối với các sản phẩm có độ nhớt cao và/hoặc có hàm lượng tế bào rất cao (ví dụ thịt quả), phép xác định dựa trên lượng mẫu thử đã cân theo quy trình thông thường.
Pha loãng mẫu để kiểm tra sao cho nồng độ axit xitric trong khoảng từ 0,02 g/l đến 0,4 g/l. Dung dịch này được sử dụng ngay cho phép xác định, kể cả khi có màu đậm. Trộn kĩ nước rau quả đục và pha loãng; nước rau quả đục và nước rau quả có màu đậm có thể cần phải được pha loãng tiếp để có hàm lượng xitrat như yêu cầu.
7.2. Tiến hành thử
7.2.1. Yêu cầu chung
Phép xác định phải thực hiện trong điều kiện nhiệt độ không đổi, khoảng từ 20 oC đến 25 oC. Có thể sử dụng nhiệt độ không đổi trong khoảng từ 25 oC đến 37 oC, miễn là thu được các kết quả tương đương.
NADH có độ hấp thụ cực đại tại bước sóng 340 nm. Khi sử dụng máy đo phổ thay đổi được bước sóng, chỉ đo tại bước sóng hấp thụ cực đại. Khi sử dụng máy đo quang đơn phổ dùng đèn hóa hơi thủy ngân, đo tại bước sóng 334 nm hoặc 365 nm.
Không sử dụng pipet một vạch để hút dung dịch. Các dung dịch enzym, coenzym và đệm có thể được lấy bằng pipet tự động thích hợp. Pipet dùng để thử nghiệm enzym (6.1) hoặc dụng cụ tương đương (6.2) phải được sử dụng để lấy dung dịch mẫu thử.
Trong phép xác định này có thể sử dụng bộ kit thử phức hợp có bán sẵn trên thị trường.
Nếu chất cần xác định có sẵn ở dạng tinh khiết thích hợp, thì có thể dùng để pha dung dịch chuẩn.
7.2.2. Dung dịch mẫu trắng
Dùng pipet lấy 1,00 ml dung dịch đệm (5.2), 0,1 ml dung dịch NADH (5.3), 2,00 ml nước và 0,02 ml huyền phù enzym MDH/LDH (5.4) cho vào cuvet. Trộn, đọc độ hấp thụ (A1)Mẫu trắng của dung dịch so với không khí (không có cuvet trên đường quang) sau khoảng 5 min.
7.2.3. Dung dịch mẫu thử
Dùng pipet lấy 1,00 ml dung dịch đệm (5.2), 0,1 ml dung dịch NADH (5.3), 0,20 ml mẫu thử, 1,80 ml nước và 0,02 ml huyền phù enzym MDH/LDH (5.4) cho vào cuvet. Trộn, đọc độ hấp thụ (A1)Mẫu của dung dịch so với không khí (không có cuvet trên đường quang) sau khoảng 5 min.
Nếu giá trị hấp thụ ban đầu quá cao (A1 > 1,000) thì thực hiện phép xác định mới, bắt đầu từ 7.2.2 và sử dụng nồng độ đã được giảm xuống của NADH. Phép đo này ảnh hưởng đến kết quả của phép thử, vì vậy dải nồng độ của mẫu thử phải được giảm xuống.
Nếu nồng độ xitrat trong dung dịch mẫu thử nhỏ hơn 0,02 g/l, thể tích mẫu được lấy để cho vào cuvet có thể được tăng lên đến khoảng 2,0 ml. Trong trường hợp này, thể tích nước được thêm vào phải giảm tương ứng sao cho cả cuvet chứa mẫu trắng và cuvet chứa mẫu thử có cùng tổng thể tích. Thể tích của dung dịch mẫu thử (V2) khi tính kết quả (xem Điều 8) phải được thay đổi tương ứng.
7.2.4. Phản ứng enzym và định lượng
Tiến hành phản ứng bằng cách thêm 0,02 ml huyền phù enzym CL (5.5) vào từng dung dịch 7.2.2 và 7.2.3. Trộn và sau khi phản ứng xảy ra hoàn toàn (khoảng 5 min đến 10 min) thì đọc độ hấp thụ (A2) của các dung dịch so với không khí (không có cuvet trên đường quang). Đọc độ hấp thụ sau 2 min để kiểm tra phản ứng đã kết thúc hay chưa.
8. Tính kết quả
Tùy theo phản ứng, tính hàm lượng NADH sử dụng (và chênh lệch độ hấp thụ, ΔA) tỉ lệ tuyến tính với nồng độ axit xitric.
ΔA = (A2 – A1)Mẫu – (A2 – A1)Mẫu trắng
Việc tính nồng độ của một chất trong dung dịch pha loãng bằng cách đo độ hấp thụ dựa trên định luật Beer-Lambert.
Hàm lượng axit xitric, ρ, tính bằng gam trên lít mẫu thử (g/l) được tính theo công thức sau:
![]()
trong đó:
|
M |
là khối lượng phân tử của axit xitric (dạng khan) M = 192,1 g/mol, tính bằng gam trên mol (g/mol); |
|
V1 |
là tổng thể tích của dung dịch trong cuvet, tính bằng mililit (ml); |
|
V2 |
là thể tích của dung dịch mẫu thử được thêm vào cuvet, tính bằng mililit (ml); |
|
F |
là hệ số pha loãng dung dịch mẫu thử; |
|
d |
là chiều dài đường quang của cuvet, tính bằng centimet (cm); |
|
ε |
là hệ số hấp thụ của NADH; |
|
|
tại bước sóng 340 nm, ε = 6,3 [l × mmol-1 × cm-1]; |
|
|
tại bước sóng 365 nm, ε = 3,4 [l × mmol-1 × cm-1]; |
|
|
tại bước sóng 334 nm, ε = 6,18 [l × mmol-1 × cm-1]. |
Nếu không thay đổi thể tích trong 7.2.3 thì tính nồng độ như sau:
![]()
Khi sử dụng bộ kit thử phức hợp có bán sẵn trên thị trường, thì hệ số 3,016 của công thức nêu trên sẽ thay đổi phụ thuộc vào tổng thể tích thử nghiệm (V1).
Trong phần tính kết quả, cần tính đến hệ số pha loãng và mối tương quan giữa giá trị với thể tích hoặc khối lượng. Nếu sản phẩm cô đặc đã được pha loãng đến nồng độ đơn thì ghi lại tỉ trọng tương đối của mẫu nồng độ đơn.
Ghi lại nồng độ axit xitric tính bằng gam trên lít đến hai chữ số thập phân.
9. Độ chụm
Chi tiết về phép thử liên phòng thử nghiệm về độ chụm của phương pháp được đưa ra trong Phụ lục A. Các giá trị thu được từ phép thử liên phòng này có thể không áp dụng cho các dải nồng độ và chất nền khác với dải nồng độ và chất nền nêu trong Phụ lục A.
9.1. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ thu được khi sử dụng cùng phương pháp, tiến hành trên vật liệu thử giống hệt nhau, do một người thực hiện, sử dụng cùng thiết bị, trong một khoảng thời gian ngắn, không được quá 5 % các trường hợp vượt quá giá trị độ lặp lại r.
Giá trị độ lặp lại:
r = 0,095 + 0,025 r g/l
trong đó: r là hàm lượng đo được, tính theo giá trị trung bình của hai kết quả thử riêng rẽ.
9.2. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ thu được khi sử dụng cùng phương pháp, tiến hành thử trên vật liệu giống thử hệt nhau, trong các phòng thử nghiệm khác nhau, do những người khác nhau thực hiện, sử dụng các thiết bị khác nhau, không được quá 5 % các trường hợp vượt quá giá trị độ tái lập R.
Giá trị độ tái lập:
R = 0,130 + 0,054 r g/l
trong đó: r là hàm lượng đo được, tính theo giá trị trung bình của hai kết quả thử riêng rẽ.
10. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
– mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử (loại mẫu, nguồn gốc của mẫu, tên gọi);
– viện dẫn tiêu chuẩn này;
– ngày và phương pháp lấy mẫu, nếu biết;
– ngày nhận mẫu;
– ngày thử nghiệm;
– kết quả thử và đơn vị biểu thị kết quả;
– độ lặp lại, nếu được kiểm tra;
– bất kỳ điểm ngoại lệ nào quan sát được trong khi thực hiện phép thử;
– mọi thao tác không quy định trong phương pháp hoặc tùy chọn mà có thể ảnh hưởng đến kết quả.
PHỤ LỤC A
(Tham khảo)
Kết quả thống kê phép thử liên phòng thử nghiệm
Theo ISO 5725:1986, các thông số sau đây đã được xác định trong một phép thử liên phòng thử nghiệm (xem Thư mục tài liệu tham khảo). Phép thử được tiến hành bởi Viện Max von Pettenkofer (Max von Pettenkofer Institute) thuộc Cơ quan Y tế liên bang (Federal Health Office), Food Chemistry Department, Berlin, BRD.
Năm tiến hành thử nghiệm: 1983
Số lượng phòng thử nghiệm tham gia: 20
Số lượng mẫu thử: 4
![]() Bảng A.1
Bảng A.1
|
Mẫu |
A |
B |
C |
D |
|
Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ Số lượng ngoại lệ (phòng thử nghiệm) Số lượng kết quả được chấp nhận |
16 4 80 |
17 3 87 |
15 5 75 |
16 4 81 |
|
Giá trị trung bình ( |
2,56 |
5,74 |
8,58 |
10,15 |
|
Độ lệch chuẩn lặp lại (sr) (g/l) Độ lệch chuẩn tương đối lặp lại (RSDr) (%) |
0,0528 2,06 |
0,092 1,61 |
0,0956 1,11 |
0,1267 1,25 |
|
Giới hạn lặp lại (r) (g/l) |
0,15 |
0,26 |
0,27 |
0,35 |
|
Độ lệch chuẩn tái lập (sR) (g/l) Độ lệch chuẩn tương đối tái lập (RSDR) (%) |
0,0933 3,64 |
0,151 2,63 |
0,2325 2,71 |
0,2214 2,18 |
|
Giới hạn tái lập (R) (g/l) |
0,26 |
0,42 |
0,65 |
0,62 |
CHÚ THÍCH: Giữa r, R và ![]() có mối quan hệ tuyến tính.
có mối quan hệ tuyến tính.
Tên mẫu:
A – nectar mơ,
B – dung dịch chuẩn,
C – nectar nho Hy Lạp đen,
D – nước cam.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Untersuchung von Lebensmitteln: Bestimmung von Citronensäure (Citrat) in Fruchtsäften: L31.00-14, 1984-11 [Food Analysis ; Determination of citric acid (citrate) in fruit juices: L31.00-14, 1984-11] – In: Amtliche Sammlung von Untersuchungsverfahren nach § 35 LMBG: Vetfahren zur Probenahme und Untersuchung von Lebensmitteln, Thbakerzeugnissen, kosmetischen Mitteln und Bedarfsffegenständen/ Bundesgesundheitsamt [In: Collection of official methods under article 35 of the German Federal Foods Act: Methods of sampling and analysis of foods, tobacco products, cosmetics and commodity goods/ Federal Health Office].
– Loseblattausgabe, Stand 31.12.1991, Bd.l.[Loose-leaf edition, as of 1991-12-31, Vol.1.]
– Berlin, Köln: Beuth Verlag GmbH.
[2] Determination of citric acid: Enzymatic method: No 22, 1985.
– In: Analyses[Collection]/International Federation of Fruit Juice Producers.
– Loose-leaf edition, as of 1989. – Zug: Swiss Fruit Union.
* ISO 5725:1986 hiện nay đã hủy, được thay bằng ISO 5725 (gồm có 6 phần) và đã được biên soạn thành bộ TCVN 6910 (gồm có 6 phần).
1) Ủy ban về enzym (EC): Classification System Enzyme Handbook (Sổ tay về Hệ thống phân loại enzym), Springer, Berlin 1969.


