Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6828:2001 (ISO 10707 : 1994) về chất lượng nước – đánh giá sự phân huỷ sinh học hiếu khí “hoàn toàn” các hợp chất hữu cơ trong môi trường nước – phương pháp phân tích nhu cầu oxy sinh hoá (thử bình kín) do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6828 : 2001
ISO 10707 : 1994
CHẤT LƯỢNG NƯỚC – ĐÁNH GIÁ SỰ PHÂN HUỶ SINH HỌC HIẾU KHÍ “HOÀN TOÀN” CÁC HỢP CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC – PHƯƠNG PHÁP PHÂN TÍCH NHU CẦU OXI SINH HOÁ (THỬ BÌNH KÍN)
Water quality – Evaluation in an aqueous medium of the “ultimete” aerobic biodegradability of organic compounds – Method by analysis of biochemical oxygen demand (closed bottle test)
Lời nói đầu
TCVN 6828 : 2001 hoàn toàn tương đương với ISO 10707 : 1994;
TCVN 6828 : 2001 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F13
Các phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
CHẤT LƯỢNG NƯỚC – ĐÁNH GIÁ SỰ PHÂN HỦY SINH HỌC HIẾU KHÍ “HOÀN TOÀN” CÁC HỢP CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC – PHƯƠNG PHÁP PHÂN TÍCH NHU CẦU OXI SINH HOÁ (THỬ BÌNH KÍN)
Water quality – Evaluation in an aqueous medium of the “ultimate” aerobic biodegradability of organic compounds – Method by analysis of biochemical oxygen demand (closed bottle test)
Cảnh báo – Chú ý an toàn – Bùn hoạt hoá và nước thải có thể chứa sinh vật có khả năng gây bệnh. Do đó cần hết sức chú ý khi làm việc với chúng. Cần chú ý cẩn thận khi làm việc với những chất thử có độc tính và hoá chất thử khi chưa biết rõ bản chất của chúng.
1 Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp phân tích nhu cầu oxi sinh hoá để đánh giá sự phân huỷ sinh học “hoàn toàn” các hợp chất hữu cơ trong môi trường nước bởi vi sinh vật hiếu khí ở nồng độ đã cho.
Những điều kiện mô tả trong tiêu chuẩn này không nhất thiết là điều kiện tối ưu để đạt mức phân huỷ sinh học hoàn toàn.
Phương pháp này áp dụng cho tất cả hợp chất hữu cơ tan hết trong nước để chuẩn bị dung dịch gốc hoặc ít tan trong nước khi sử dụng các kỹ thuật định lượng đặc biệt.
Do nồng độ hợp chất thử thấp khi bắt đầu phép thử, nên thường không cần thiết phải có những phòng ngừa đặc biệt về độc tính của hợp chất thử đối với các vi sinh vật của chất cấy; nếu cần, có thể tiến hành song song phép thử sự ức chế.
2 Tiêu chuẩn trích dẫn
ISO 5813 : 1983 Chất lượng nước – Xác định oxi hoà tan – Phương pháp chuẩn độ iôt.
ISO 5814 : 1990 Chất lượng nước – Xác định oxi hoà tan – Phương pháp dò điện hoá.
TCVN 6491 : 1999 (ISO 6060 : 1989) Chất lượng nước – Xác định nhu cầu oxi hoá học.
ISO 9887 : 1992 Chất lượng nước – Đánh giá sự phân huỷ sinh học hiếu khí các hợp chất hữu cơ trong môi trường nước – Phương pháp cặn hoạt hoá bán liên tục (SCAS).
ISO 9888 : 1991 Chất lượng nước – Đánh giá sự phân huỷ sinh học hiếu khí các hợp chất hữu cơ trong môi trường nước – Phép thử tĩnh (phương pháp Zahn-Wellens).
TCVN 6494 – 2 : 2000 (ISO 10304 – 2) Chất lượng nước – Xác định các anion hoà tan bằng phương pháp sắc ký lỏng ion – Phần 2 : Xác định bromua, clorua, nitrat, nitrit, octophosphat và sunfit trong nước thải.
ISO 10634:1995 Chất lượng nước – Hướng dẫn chuẩn bị và xử lý các chất hữu cơ khó tan trong nước để đánh giá sự phân huỷ sinh học của chúng trong môi trường nước.
3 Định nghĩa
Trong tiêu chuẩn này, các định nghĩa sau đây được sử dụng:
3.1 Sự phân huỷ sinh học hoàn toàn : Mức phân huỷ đạt được khi các hợp chất thử bị phân huỷ hoàn toàn bởi các vi sinh vật tạo thành cacbon dioxit, nước, muối khoáng và các các thành phần của tế bào vi khuẩn mới (sinh khối).
3.2 Nhu cầu oxi sinh hoá (BOD) : Nồng độ oxi hoà tan tiêu tốn cho sự oxi hoá một hợp chất hữu cơ và/hoặc chất vô cơ trong nước, dưới những điều kiện nhất định, được biểu thị bằng miligam oxi tiêu tốn ứng với một miligam hoặc gam hợp chất thử.
3.3 Nhu cầu oxi hoá học (COD) : Lượng oxi tiêu tốn trong quá trình oxi hoá hợp chất thử bằng dicromat khi đun nóng trong môi trường axit. Nó cho phép đo lượng chất có thể oxi hoá có mặt và được biểu thị bằng miligam oxi tiêu tốn ứng với một miligam hoặc gam hợp chất thử.
3.4 Nhu cầu oxi lý thuyết (ThOD): Tổng lượng oxi cần để oxi hoá hoàn toàn một hoá chất. Nó được tính từ công thức phân tử và được biểu thị bằng miligam oxi cần thiết trên miligam hoặc gam hợp chất thử.
3.5 Phơi nhiễm trước : ủ trước chất cấy trong sự có mặt của hợp chất thử, để tăng khả năng của chất cấy làm phân huỷ hợp chất thử. Nếu đạt được mục đích này thì chất cấy đã thích nghi.
3.6 Thích nghi trước : ủ trước chất cấy dưới các điều kiện thử nghiệm khi không có mặt hợp chất thử để cải thiện tính năng của phép thử.
4 Nguyên tắc
Dung dịch hợp chất thử hữu cơ trong môi trường khoáng là nguồn duy nhất cung cấp cacbon và năng lượng, dung dịch này được cấy một lượng vi sinh vật tương đối nhỏ từ quần thể hỗn hợp và được giữ trong các bình đầy, đậy kin, để nơi tối ở nhiệt độ ổn định. Phân tích lượng oxi hoà tan qua chu kỳ 28 ngày để đánh giá sự phân huỷ sinh học. Lượng oxi tiêu tốn cho hoá chất thử (BOD) được hiệu chỉnh cho lượng oxi tiêu tốn cho phép thử trắng không chứa chất cấy trong phép thử song song, được biểu thị bằng phần trăm ThOD hoặc COD.
5 Điều kiện môi trường thử
Tiến hành ủ nơi tối trong môi trường kín, có nhiệt độ ổn định (± 1oC) trong khoảng từ 20oC đến 25oC.
6 Thuốc thử
Chỉ dùng các thuốc thử tinh khiết phân tích.
6.1 Nước
Nước cất hoặc nước đã loại ion không chứa các chất độc gây ức chế, chứa nhỏ hơn 10 % hàm lượng các bon hữu cơ hoà tan (DOC) ban đầu do chất thử đưa vào. Đối với từng dãy thử chỉ sử dụng một mẻ nước.
6.2 Môi trường thử
6.2.1 Thành phần
6.2.1.1 Dung dịch a)
Kali dihydrophosphat khan (KH2PO4) 8,5 g
Dikali hydrophosphat khan (K2HPO4) 21,75 g
Dinatri hydrophosphat ngậm 2 nước (Na2HPO4.2H2O) 33,4 g
Amoni clorua (NH4Cl) 0,5 g
Hoà tan các thành phần trên trong nước (6.1) và thêm nước cho đến 1 000 ml.
Chú thích – Thành phần đúng của môi trường có thể kiểm tra bằng cách đo chỉ số pH, pH nên là 7,4.
6.2.1.2 Dung dịch b)
Hoà tan 22,5 g magie sunphat ngậm 7 nước (MgSO4.7H2O) trong nước (6.1) và pha loãng đến 1000 ml.
6.2.1.3 Dung dịch c)
Hoà tan 27,5 g canxi clorua (CaCl2 ) hoặc 36,4 g canxi clorua ngậm 2 nước (CaCl2.2H2O) trong nước (6.1) và pha loãng đến 1000 ml.
6.2.1.4 Dung dịch d)
Hoà tan 0,25 g sắt (III) clorua ngậm 6 nước (FeCl3.6H2O) trong nước (6.1) và pha loãng đến 1000ml.
Để không phải pha dung dịch này ngay trước khi dùng thì thêm một giọt axit clohidric đậm dặc (HCl) hoặc 0,4 g axit etylen diamin tetra axetic (EDTA) (muối dinatri) trên lít.
6.2.2 Chuẩn bị môi trường thử
Để pha một lít môi trường thử, thêm 1 ml của mỗi dung dịch a), b) c) và d) (6.2.1) vào khoảng 500ml nước (6.1) và pha loãng đến 1 000 ml.
Sục mạnh khí vào môi trường thử ít nhất 20 phút. Tiến hành các loạt thử bằng môi trường thử thu được từ cùng một đợt chuẩn bị. Nhìn chung, môi trường đã sẵn sàng để sử dụng sau khi để yên 20 h ở nhiệt độ thử nghiệm. Xác định nồng độ oxi hoà tan dùng cho mục đích kiểm tra; giá trị này nên ở khoảng 9 mg/l ở 20oC. Thực hiện các thao tác chuyển và làm đầy môi trường đã bão hoà không khí không chứa bọt khí, thí dụ, bằng cách dùng siphông.
7 Thiết bị, dụng cụ
Dùng các thiết bị thông thường trong phòng thí nghiệm và:
7.1 Bình dùng cho nhu cầu oxi sinh hoá (BOD) có nắp đậy bằng thuỷ tinh, dung tích từ 250ml đến 300 ml. Các bình này được làm kín khí bằng bôi trơn. Trong trường hợp này, chỉ sử dụng mỡ không chứa cacbon hữu cơ, thí dụ: mỡ silicon.
7.2 Nồi cách thuỷ, hoặc tủ ấm, để giữ các bình ở nhiệt độ thử ổn định, tránh ánh sáng.
7.3 Bình thuỷ tinh dung tích lớn, dung tích từ 2 lít đến 5 lít dùng để chuẩn bị môi trường và để làm đầy các bình BOD.
7.4 Điện cực oxi và máy đo, hoặc thiết bị để xác định oxi bằng chuẩn độ iôt.
7.5 pH mét
8 Cách tiến hành
8.1 Chuẩn bị dung dịch hợp chất thử
Chuẩn bị dung dịch gốc của hợp chất thử trong nước (6.1) hoặc môi trường thử (6.2.2) (thí dụ 1 g/l).
Thêm một thể tích đủ dung dịch gốc này vào bình thuỷ tinh dung tích lớn (7.3) có chứa một thể tích đã biết trước của môi trường thử (6.2.2) sao cho nồng độ hoàn toàn của hoá chất là 2 mg/l. Nồng độ này thường thích hợp cho nồng độ oxi không giảm xuống dưới 0,5 mg/l trong quá trình thử và hoạt tính của chất cấy không bị hạn chế. Đối với các hợp chất phân huỷ sinh học kém và các hợp chất có ThOD thấp, thì có thể sử dụng nồng độ cuối cùng lên đến 10 mg/l.
Trong một vài trường hợp, thí dụ nếu như dự đoán trước là sự phân huỷ kém hoặc phân huỷ ít, thì nên thực hiện các dãy hoá chất thử song song ở hai nồng độ khác nhau, thí dụ như 2 mg/l và 5 mg/l. Thông thường, tính ThOD trên cơ sở việc tạo thành các muối amoni, nhưng nếu biết chắc rằng đã xảy ra sự nitrat hoá hoặc biết rằng đã xuất hiện thì tính ThOD trên cơ sở hình thành nitrat. Tuy nhiên nếu việc nitrat hoá có xảy ra nhưng không hoàn toàn thì hiệu chỉnh sự thay đổi nồng độ của nitrat và nitrit xác định được bằng phép phân tích (xem phụ lục C).
Khi các hợp chất thử khó tan trong nước mà không thể chuẩn bị được dung dịch gốc, thì thêm lượng hợp chất thử cần thiết trực tiếp vào bình BOD (7.1). Chỉ sử dụng các bình thuỷ tinh dung tích lớn (7.3) để bổ sung môi trường thử đã cấy (6.2.2). Tránh làm thất thoát môi trường thử và hợp chất thử khi đậy nắp bình. Về chi tiết, xem ISO 10634.
8.2 Chuẩn bị dung dịch chất đối chứng
Chuẩn bị dung dịch gốc chất hữu cơ đã biết khả năng phân huỷ sinh học, thí dụ như natri axetat, natri benzoat hoặc anilin trong môi trường thử (6.2.2). Cũng tương tự đối với hợp chất thử, thêm một lượng dung dịch gốc vào bình dung tích lớn (7.3) để có được nồng độ thử là 2 mg/l.
8.3 Chuẩn bị kiểm tra sự ức chế
Nếu cần nghiên cứu tính độc của hợp chất thử (thí dụ như ở trường hợp đó chỉ số phân huỷ sinh học tìm được thấp), thì cần thiết phải có một loạt các bình khác. Chuẩn bị một bình thuỷ tinh dung tích lớn khác (7.3) đựng môi trường khoáng với hợp chất thử đã sục khí và hợp chất đối chứng có các nồng độ cuối cùng giống các nồng độ trong các bình dung tích lớn khác. Thêm hỗn hợp này vào các bình BOD (7.1).
8.4 Chuẩn bị chất cấy
Trong phép thử này sử dụng chất cấy không có kết tủa bùn. Nó nên được lấy từ nhánh nước thải thứ hai của trạm xử lý hoặc từ phòng thí nghiệm nhận phần lớn nước thải sinh hoạt hoặc từ nước bề mặt. Có thể sử dụng các hỗn hợp của các nguồn khác nhau này.
Lấy mẫu mới và giữ ở môi trường hiếu khí trong suốt quá trình vận chuyển. Nếu có mặt chất rắn lơ lửng thì để yên trong 1 h hoặc lọc qua giấy lọc thô và giữ mẫu này ở các điều kiện hiếu khí cho đến khi thử.
Sử dụng một thể tích thích hợp các mẫu này, giới hạn từ một giọt (khoảng 0,05 ml) đến 5 ml trên lit cho vào các bình thuỷ tinh dung tích lớn để ủ. Có thể cần đến các phép thử để cho biết thể tích tối ưu. Nếu cần, cô đặc chất cấy bằng cách lọc hoặc ly tâm.
Chú thích
2) Thể tích thích hợp có nghĩa là :
– đủ để thu được quần thể vi sinh có đủ hoạt tính phân hủy sinh học;
– phân huỷ hợp chất đối chứng bằng đúng phần trăm đã qui định;
– cho từ 103 đến 106 tế bào hoạt động trong một mililit;
3) Nếu sự tiêu thụ oxi trong các bình thử trắng không chứa hợp chất thử mà quá cao (> 1,5 mg/l ở cuối thử nghiệm), thì nên xử lý trước bằng cách sục khí chất cấy từ 1 ngày đến 7 ngày. Điều đó có thể giảm được sự tiêu thụ oxi của các vi sinh vật trong mẫu trắng.
4) Trong một số trường hợp nhất định có thể sử dụng chất cấy đã phơi nhiễm trước. Khi sử dụng các chất cấy đó thì cần nêu rõ trong báo cáo kết quả (thí dụ phần trăm phân huỷ sinh học = x%, sử dụng chất cấy đã phơi nhiễm trước) và nêu chi tiết phương pháp cấy phơi nhiễm trước. Chất cấy đã được cấy phơi nhiễm trước có thể lấy từ phòng thí nghiệm thử phân huỷ sinh học dưới các điều kiện thích hợp khác nhau [thí dụ thử Zahn-Wellen (ISO 9888) và thử SCAS (ISO 9887)] hoặc từ các mẫu lấy từ các nơi có điều kiện môi trường tương ứng (thí dụ trạm xử lý các chất tương tự hoặc các khu vực bị ô nhiễm).
8.5 Chuẩn bị bình thử
Chuẩn bị đồng thời các loạt bình thử BOD (7.1) để xác định hợp chất thử và chất đối chứng, kiểm tra sự ức chế và các giá trị mẫu trắng trong các loạt thí nghiệm đồng thời. Chuẩn bị đủ số bình BOD để đo oxi tiêu thụ ở các khoảng thời gian thử, thông thường ít nhất là sau 0 ngày, 7 ngày, 14 ngày, 21 ngày và 28 ngày.
Trong một loạt thử điển hình số bình được sử dụng như sau :
– ít nhất 10 bình chứa hợp chất thử và chất cấy (FT);
– ít nhất 10 bình chứa hợp chất đối chứng và chất cấy (FC);
– ít nhất 10 bình chỉ chứa chất cấy (mẫu trắng) (FB);
và nếu cần
– ít nhất 6 bình chứa hợp chất thử, hợp chất đối chứng và chất cấy (kiểm tra ức chế) (FI).
Cho môi trường khoáng đã sục khí (6.2.2) vào các bình thuỷ tinh dung tích lớn (7.3) để có được khoảng một phần ba bình. Sau đó thêm đủ lượng các dung dịch hợp chất thử gốc, hợp chất đối chứng vào các bình riêng rẽ để có được nồng độ cuối cùng của các hoá chất như mong muốn. Không cho bất kỳ một hoá chất nào vào môi trường kiểm tra mẫu trắng đựng trong bình thuỷ tinh dung tích lớn khác. ủ các bình dung tích lớn chứa thể tích chất cấy thích hợp (8.4), pha loãng các dung dịch bằng môi trường thử đã sục khí và trộn kỹ.
Phân phối ngay mỗi dung dịch đã chuẩn bị vào các nhóm bình BOD tương ứng, thí dụ : dùng siphông đặt đầu vào của siphông cách đáy khoảng 1/4 chiều cao của bình dung tích lớn (chứa dung dịch đã chuẩn bị) (không chạm đáy) để làm đầy các bình BOD. Rút nhẹ ống siphông để loại bỏ hết bọt khí.
8.6 Tiến hành thử
Phân tích ngay oxi hoà tan của các bình ở thời điểm zero (xem 8.5) sử dụng điện cực (xem ISO 5814).
Chú thích 5 – Có thể sử dụng phương pháp Winkler để đo oxi hoà tan (xem ISO 5813). Trong trường hợp này, lượng chứa trong các bình có thể được bảo quản để phân tích tiếp bằng cách cho mangan (II) sunfat và natri hidroxit. Nên bảo quản các bình đã được đậy cẩn thận nơi tối ở nhiệt độ từ 10oC đến 20oC không quá 24 h trước khi bắt đầu các bước còn lại của phương pháp Winkler.
Đậy các bình còn lại trong khi vẫn đảm bảo được các bình này không chứa bọt khí và ủ ở nơi tối ở nhiệt độ thử. Từ tất cả các dãy, lấy ít nhất những bình kép để phân tích oxi hoà tan sau 7 ngày, 14 ngày, 21 ngày và để phân tích tối đa sau 28 ngày. Đo nồng độ oxi theo cách tương tự như trong các bình ở thời điểm zero.
Đối với các hợp chất thử có chứa nitơ, cần chỉnh lượng oxi tiêu tốn cho nitrat hoá (xem phụ lục C). Để làm được điều này, lấy mẫu từ bình thuỷ tinh dung tích lớn (7.3) khi bắt đầu phép thử và dùng mẫu này để phân tích nitrit và nitrat, thí dụ theo phương pháp qui định trong TCVN 6494–2 : 2000 (ISO 10304-2). Tiến hành xác định tương tự đối với mẫu lấy từ bình BOD ở cuối của phép thử. Nếu sử dụng phương pháp Winkler (xem ISO 5813), thì chuẩn bị thêm một bình nữa. Tính lượng oxi đã sử dụng để nitrat hoá từ sự thay đổi nồng độ của nitrat và nitrit.
9 Tính toán và biểu thị kết quả
9.1 Tính toán
Trước tiên tính lượng oxi tiêu tốn sau mỗi chu kỳ bằng cách lấy lượng oxi tiêu tốn của hợp chất thử (đối với từng bình thử một) trừ đi lượng oxi của mẫu trắng (giá trị trung bình của mẫu kép). Chia giá trị này cho nồng độ của hợp chất thử để có được BOD đặc trưng, được biểu thị bằng miligam oxi trên miligam hợp chất thử. Tính phần trăm phân huỷ sinh học, bằng cách chia BOD đặc trưng cho ThOD đặc trưng (xem phụ lục A). Nếu không thể xác định được ThOD, hoặc để làm thông tin bổ sung, thì sử dụng giá trị COD đo được (xem phụ lục B). Các bước tính toán này được kết hợp trong công thức (1). Nên chú ý rằng hai phương pháp này không nhất thiết phải cho các kết quả giống nhau. COD thường nhỏ hơn ThOD, sao cho phần trăm phân huỷ sinh học của hợp chất thử tại thời điểm t (Dt) sử dụng COD có thể cao hơn khi sử dụng ThOD. Cuối cùng, tính giá trị trung bình từ phần trăm thu được của các phép thử khi thử song song :
![]()
trong đó
Dt là phần trăm phân huỷ sinh học của hợp chất thử tại thời điểm t;
ρ0 là nồng độ oxi có trong các bình thử tại thời điểm zero, tính bằng miligam trên lít;
ρ0,t là nồng độ oxi có trong các bình thử tại thời điểm t, tính bằng miligam trên lít;
ρ0,b là nồng độ oxi trung bình có trong các bình mẫu trắng tại thời điểm zero, tính bằng miligam trên lít;
ρ0,t,b là nồng độ oxi trung bình có trong các bình mẫu trắng tại thời điểm t, tính bằng miligam trên lít;
ThOD là nhu cầu oxi lý thuyết, được biểu thị bằng miligam ứng với một miligam hợp chất thử;
ρc là nồng độ của hợp chất thử có trong các bình thử, tính bằng miligam trên lít. Làm tròn các kết quả tính bằng phần trăm đến số nguyên gần nhất.
Tiến hành tính tương tự đối với hợp chất đối chứng và nếu sử dụng, kiểm tra sự ức chế.
Đối với các hợp chất thử chứa nitơ, sử dụng ThOD tương ứng cho trường hợp biết trước hoặc dự đoán được là có xảy ra nitrat hoá. Nếu có xảy ra nitrat hoá nhưng không hoàn toàn thì tính sự hiệu chỉnh cho oxi tiêu tốn do nitrat hoá từ chênh lệch nồng độ của nitrit và nitrat trong suốt quá trình thử (xem phụ lục C).
9.2 Biểu thị kết quả
Dựng đồ thị trung bình phần trăm phân huỷ sinh học (Dt) theo thời gian (đường cong phân huỷ sinh học). Từ đường cong này, xác định các thông số phân huỷ sinh học, đặc biệt là pha trễ, thời gian phân huỷ và mức phân huỷ cực đại.
Chú thích
6) Trong phần lớn các đường cong phân huỷ có thể quan sát thấy pha trễ. Thời gian này được xác định là thời gian tính từ khi bắt đầu ủ cho đến khi độ phân huỷ đã tăng được khoảng 10% độ phân huỷ cuối cùng theo lý thuyết (ThOD hoặc COD). Pha trễ thường biến thiên nhiều và khả năng tái lập thấp. Điều này nên được ghi lại theo từng ngày.
Mức phân huỷ tối đa được xác định là mức mà cao hơn mức này không có sự phân huỷ nào xảy ra tiếp trong quá trình thử .
Thời gian phân huỷ được tính là thời gian tính từ khi kết thúc pha trễ đến thời điểm đạt được khoảng 90% mức phân huỷ tối đa. Ghi lại thời gian phân huỷ theo ngày.
7) Do số lượng các giá trị đo được trong bình thử kín bị hạn chế, nên pha trễ và thời gian phân huỷ thường chỉ được ước tính.
10 Tính đúng đắn của phép thử
Lượng oxi tiêu tốn trong kiểm tra mẫu trắng chất cấy sau 28 ngày không được vượt quá 1,5 mg/l. Khi thu được các giá trị cao hơn thì cần phải xem xét kỹ thuật thực hành và chất cấy được sử dụng. Để giảm bớt giá trị thử mẫu trắng này thì thích nghi trước bằng cách sục khí chất cấy suốt từ 1 ngày đến 7 ngày.
ở bất kỳ thời điểm nào thì nồng độ oxi dư lại trong các bình thử không được thấp dưới 0,5 mg/l.
Phép thử được xem là đúng, nếu chênh lệch của các giá trị kép cực đại nhỏ hơn 20% ở cuối phép thử. Nếu 1 trong 3 giá trị kép nằm ngoài phạm vi này, thì xem đó là một ngoại lệ và sử dụng các giá trị còn lại. Phần trăm phân huỷ của hợp chất đối chứng phải đạt được 60% sau 14 ngày. Nếu một trong các điều kiện này không thoả mãn thì lặp lại phép thử. Do tính nghiêm ngặt của phương pháp này nên các giá trị phân huỷ sinh học thấp không nhất thiết có nghĩa là hợp chất thử không có khả năng phân huỷ sinh học dưới các điều kiện môi trường, nhưng điều này cho thấy rằng cần phải tiến hành nhiều hơn để thiết lập độ phân huỷ sinh học.
Trong thử nghiệm sự ức chế chứa cả hợp chất thử và cả hợp chất đối chứng, nếu sau 14 ngày mà thu được dưới 25% tính theo tổng ThOD hoặc COD, thì có nghĩa là hợp chất thử bị ức chế. Lặp lại các dãy thử, nếu có thể thì sử dụng hợp chất thử với nồng độ thấp hơn.
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm ít nhất các thông tin sau:
a) trích dẫn tiêu chuẩn này;
b) mọi thông tin cần để nhận dạng hợp chất thử và nồng độ chất thử;
c) mọi số liệu thu được (thí dụ dạng bảng), đường cong phân huỷ và phần trăm phân huỷ của hợp chất thử;
d) tên chất đối chứng đã dùng, các số liệu thu được, đường cong phân huỷ và phần trăm phân huỷ;
e) nguồn, đặc tính, thể tích chất cấy đã dùng và thông tin về xử lý sơ bộ chất cấy đã dùng, thí dụ phơi nhiễm trước hoặc thích nghi trước;
f) phương pháp đo oxi đã dùng;
g) nhiệt độ ủ của phép thử;
h) phần trăm phân hủy trong kiểm tra ức chế (nếu sử dụng);
i) lý do trong trường hợp loại bỏ phép thử;
j) mọi sự thay đổi của qui trình chuẩn hoặc mọi tình huống có thể ảnh hưởng đến kết quả.
Phụ lục A
(tham khảo)
XÁC ĐỊNH NHU CẦU OXI LÝ THUYẾT (THOD)
A.1 Tính toán
Nhu cầu oxi lý thuyết (ThOD) có thể tính toán nếu thành phần nguyên tố đã biết hoặc đã xác định .
Thí dụ
CcHhClclNnNanaOoPpSs có phân tử lượng tương ứng là Mr.
A.1.1 Khi không có nitrat hoá
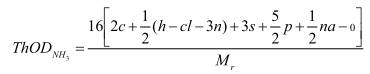
trong đó H tính cho H2O, C tính cho CO2, P tính cho P2O5, Na tính cho Na2O, Cl tính cho HCl và N tính cho NH3.
A.1.2 Khi có nitrat hoá
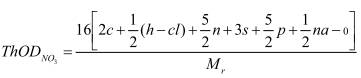
trong trường hợp này N cuối cùng được chuyển về NO3.
A.2 Thí dụ : Glucoza (C6H12O6) Mr = 180 g
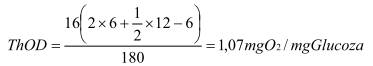
Phụ lục B
(tham khảo)
XÁC ĐỊNH NHU CẦU OXI HOÁ HỌC (COD)
Nhu cầu oxi hoá học (COD) của các chất hữu cơ tan trong nước được xác định bằng các qui trình đã được thiết lập, thí dụ theo TCVN 6491: 1999 (ISO 6060). Thông thường và đặc biệt là trong trường hợp của các chất ít tan, COD được xác định một cách dễ dàng khi dùng một trong các phương pháp phân tích trên, nghĩa là trong hệ thống kín với áp suất cân bằng (Kelkenberg2)). Trong trường hợp này có thể xác định tốt những chất mà các phương pháp thông thường gặp khó khăn, thí dụ axit axetic.
Phương pháp này có thể thất bại, ví dụ với trường hợp pyridin. Nếu nồng độ kali dicromat tăng từ 0,016 N (0,0026 mol/l) đến 0,25 N (0,0416 mol/l) như qui định của Kelkenber, thì cân trực tiếp từ 5 mg đến 10 mg chất là làm dễ dàng, đó là điều căn bản cho việc xác định COD của các chất ít tan trong nước.
Phụ lục C
(tham khảo)
HIỆU CHỈNH LƯỢNG OXI TIÊU TỐN KHI CÓ NITRAT HOÁ
Sai số do không tính đến sự nitrat hoá khi đánh giá sự phân huỷ sinh học bằng oxi tiêu tốn của các chất thử không chứa nitơ là không quan trọng, thậm chí nếu việc oxi hoá nitơ amoni trong môi trường xảy ra bất thường, như trong trường hợp giữa các bình thử và bình mẫu trắng. Tuy nhiên, đối với các chất thử chứa nitơ thì có thể xảy ra sai số nghiêm trọng.
Nếu nitrat hoá xảy ra nhưng không hoàn toàn, thì lượng oxi tiêu tốn bởi hỗn hợp phản ứng có thể hiệu chỉnh cho lượng oxi dùng để oxi hoá amoni thành nitrit và nitrat, nếu sự thay đổi nồng độ của nitrit và nitrat trong quá trình ủ được xác định bằng cách tính đến các phương trình sau:

Tổng cộng
2NH4Cl + 4O2 → 2HNO3 + 2HCl + 2H2O …(C.3)
Từ phương trình (C.1), lượng oxi tiêu tốn để oxi hoá 28 g nitơ chứa trong amoni clorua (NH4Cl) đến nitrit là 96 g, nghĩa là hệ số của 96/28 = 3,43. Cũng tương tự, từ phương trình (C.3), lượng oxi tiêu tốn để oxi hoá 28 g nitơ đến nitrat là 128 g, nghĩa là hệ số của 128/28 = 4,57.
Vì các phản ứng xảy ra liên tiếp, được thực hiện bởi các loài vi khuẩn khác nhau nên nồng độ nitrit có thể tăng hoặc giảm. Khi nồng độ nitrit giảm, một nồng độ tương đương nitrat có thể được tạo thành. Như vậy, lượng oxi tiêu tốn để tạo thành nitrat là 4,57 nhân với sự tăng nồng độ nitrat-N, trong khi lượng oxi tiêu tốn để tạo thành nitrit là 3,43 nhân với sự tăng nồng độ nitrit-N. Với sự giảm nồng độ, thì lượng oxi “mất đi” là 3,43 nhân với sự giảm nồng độ nitrit.
|
|
|
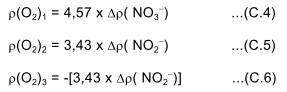
trong đó
ρ(O2)1 là oxi tiêu tốn để tạo thành nitrat;
ρ(O2)2 là oxi tiêu tốn để tạo thành nitrit;
ρ(O2)3 là oxi “thất thoát” để làm biến mất nitrit;
∆ρ( NO3–) là sự tăng nồng độ nitrat-N;
∆ρ( NO2–) là sự thay đổi nồng độ nitrit-N;
Sử dụng các công thức (C.4) và (C.5) hoặc (C.6) :
![]()
do đó
![]()
trong đó
ρ(O2)4 là lượng oxi tiêu tốn để nitrat hoá;
ρ(O2)5 là lượng oxi tiêu tốn để oxi hoá cacbon;
ρ(O2)6 là tổng lượng oxi tiêu tốn.
Nếu ″nitơ bị oxi hoá tổng số″ xác định được thì lượng oxi tiêu tốn cho sự nitrat hoá có thể lấy gần đúng là 4,57 lần tăng nồng độ nitơ bị oxi hoá.
Giá trị hiệu chỉnh cho lượng oxi tiêu tốn do oxi hoá cacbon được so sánh với ThODNH3 như được tính toán ở phụ lục A.
2) Kelkenberg, K.Z. Wasser và Abwasserforschung, 8, 146 (1975).


