Tiêu chuẩn Việt Nam TCVN 6848:2001 về Vi sinh vật học – Hướng dẫn chung về định lượng Coliform – Kỹ thuật đếm khuẩn lạc do Bộ Khoa học Công nghệ và Môi trường ban hành đã được thay thế bởi Tiêu chuẩn quốc gia TCVN 6848:2007 (ISO 4832:2007) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Phương pháp định lượng Coliform – Kỹ thuật đếm khuẩn lạc .
Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6848:2001 về Vi sinh vật học – Hướng dẫn chung về định lượng Coliform – Kỹ thuật đếm khuẩn lạc do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6848 : 2001
VI SINH VẬT HỌC – HƯỚNG DẪN CHUNG VỀ ĐỊNH LƯỢNG COLIFORM – KỸ THUẬT ĐẾM KHUẨN LẠC
Microbiology – General guidance for the enumeration of coliforms – Colony count technique
1. Phạm vi áp dụng
Tiêu chuẩn này đưa ra hướng dẫn chung để định lượng coliform có trong thực phẩm hoặc thức ăn chăn nuôi bằng kỹ thuật đếm khuẩn lạc trên môi trường đặc sau khi nuôi cấy ở 300C, 350C hoặc 370C, nhiệt độ này cần được thỏa thuận giữa các bên có liên quan.
Chú thích 1 – Nhiệt độ nuôi cấy ở 300C chỉ dùng để định lượng mang tính chất kỹ thuật, nhiệt độ 350C hoặc 370C được dùng nhiều trong lĩnh vực sức khỏe cộng đồng.
2. Tiêu chuẩn viện dẫn
TCVN 4881 : 1989 (ISO 6887 : 1983), Vi sinh vật học – Hướng dẫn chung về cách pha chế các dung dịch pha loãng để kiểm nghiệm vi sinh vật.
TCVN 6404 : 1998 (ISO 7218 : 1997), Vinh sinh vật trong thực phẩm và trong thức ăn gia súc – Nguyên tắc chung về kiểm tra vi sinh vật.
3. Định nghĩa
Trong tiêu chuẩn này áp dụng định nghĩa sau:
Coliform (Coliform): Vi khuẩn ở nhiệt độ xác định (nghĩa là ở 300C, 350C hoặc 370C theo thỏa thuận) tạo nên các khuẩn lạc đặc trưng trong thạch lactoza mật đỏ trung tính tím tinh thể dưới các điều kiện thử quy định trong tiêu chuẩn này.
4. Nguyên tắc
4.1. Chuẩn bị một bộ gồm hai đĩa rót và sử dụng môi trường nuôi cấy chọn lọc đặc, và lấy một lượng mẫu thử theo quy định nếu là sản phẩm ban đầu là chất lỏng, hoặc lấy một lượng huyền phù ban đầu theo quy định nếu các sản phẩm ở dạng khác.
Chuẩn bị cặp đĩa thạch khác trong cùng một điều kiện, dùng các dung dịch pha loãng thập phân của mẫu thử hoặc huyền phù ban đầu.
4.2. Ủ các đĩa ở 300C, 350C hoặc 370C (theo thỏa thuận) trong 24h.
4.3. Tính số coliform có trên mililit hoặc trên gam mẫu từ số khuẩn lạc đặc trưng thu được trong các đĩa được chọn (xem 10.1).
5. Môi trường nuôi cấy và chất lỏng pha loãng
5.1. Khái quát
Thực hành phòng thí nghiệm, xem TCVN 6404 : 1998 (ISO 7218).
5.2. Chất lỏng pha loãng
Xem TCVN 4881 : 1989 (ISO 6887) và các tiêu chuẩn liên quan đến sản phẩm xét nghiệm.
5.3 Môi trường chọn lọc đặc: Thạch lactoza mật đỏ trung tính tím tinh thể (VRBL)
Thành phần
|
pepton |
7 g |
|
Cao men |
3 g |
|
Lactoza |
10 g |
|
Natri clorua |
5 g |
|
Muối mật (bile salts) |
1,5 g |
|
Đỏ trung tính |
0,03 g |
|
Tím tinh thể |
0,002 g |
|
Thạch |
12 g đến 18 g 1) |
|
Nước |
1 000 ml |
Chuẩn bị
Tiến hành như sau để giữ được tính chọn lọc và đặc trưng của môi trường.
Trộn kỹ các thành phần hoặc môi trường hoàn chỉnh khô trong nước và để yên vài phút. Chỉnh pH sao cho sau khi đun sôi ở 250C pH bằng 7,4. Đun đến sôi và thỉnh thoảng khuấy cho tan hết.
Giữ sôi trong 2 phút. Làm nguội ngay môi trường trong nồi cách thủy (6.5) có nhiệt độ 450C.
Tránh làm quá nhiệt môi trường, nghĩa là đun nóng quá lâu hoặc đun lại. Do đó, không được thanh trùng trong nồi áp lực và cần kiểm tra độ vô trùng của môi trường tại thời điểm sử dụng (xem 9.2.2).
Sử dụng môi trường trong vòng 3 h sau khi chuẩn bị.
6. Thiết bị và dụng cụ thủy tinh
Chú thích 2 – Có thể sử dụng thiết bị, dụng cụ dùng một lần thay cho việc sử dụng lại dụng cụ thủy tinh nếu chúng đáp ứng được các yêu cầu phù hợp.
Các thiết bị thông thường của phòng thí nghiệm vi sinh vật và đặc biệt là
6.1. Thiết bị để thanh trùng khô (tủ sấy) hoặc để thanh trùng ướt (nồi hấp áp lực)
Xem TCVN 6404 : 1998 (ISO 7218).
6.2. Tủ ấm, có thể hoạt động ở 300C ± 10C, 350C ± 10C, hoặc 370C ± 10C.
6.3. Đĩa Petri, bằng thủy tinh hoặc bằng chất dẻo có đường kính từ 90 mm đến 100 mm.
6.4. Pipet xả hết, có dung tích danh định 1 ml.
6.5. Nồi cách thủy, hoặc thiết bị tương tự có thể duy trì nhiệt độ ở 450C ± 0,50C.
6.6.Thiết bị đếm khuẩn lạc, gồm một nguồn chiếu sáng illumined và dụng cụ đếm cơ hoặc điện tử.
6.7. pH met, chính xác đến ± 0,1 đơn vị pH ở 250C.
7. Lấy mẫu
Lấy mẫu theo tiêu chuẩn cụ thể thích hợp đối với sản phẩm tương ứng. Nếu không có các tiêu chuẩn như vậy thì các bên liên quan cần thỏa thuận với nhau về vấn đề này.
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu theo tiêu chuẩn cụ thể thích hợp đối với sản phẩm có liên quan. Nếu không có các tiêu chuẩn như vậy thì các bên liên quan cần thỏa thuận với nhau về vấn đề này.
9. Cách tiến hành
9.1. Phần mẫu thử, huyền phù ban đầu và dịch pha loãng
Xem TCVN 4881 : 1989 (ISO 6887) và tiêu chuẩn thích hợp liên quan đến sản phẩm.
9.2. Cấy và nuôi mẫu
9.2.1. Lấy hai đĩa Petri vô trùng (6.3). Dùng pipet vô trùng (6.4) cho vào đĩa 1 ml mẫu thử nếu là sản phẩm lỏng, hoặc 1 ml huyền phù ban đầu nếu là các sản phẩm ở dạng khác.
Lấy hai đĩa Petri vô trùng khác. Dùng pipet mới vô trùng cho vào mỗi đĩa 1ml dịch pha loãng thập phân đầu tiên (10-1) của mẫu thử nếu đó là sản phẩm lỏng, hoặc 1 ml dịch pha loãng thập phân đầu tiên (10-2) của huyền phù ban đầu nếu sản phẩm ở dạng khác.
Dùng pipet mới vô trùng lặp lại trình tự đã mô tả với các dịch pha loãng thập phân tiếp theo.
9.2.2. Rót khoảng 15 ml môi trường VRBL (5.3) ở 450C ± 0,50C vào mỗi đĩa Petri. Thời gian tính từ khi kết thúc khâu chuẩn bị huyền phù ban đầu (hoặc dịch pha loãng 1/10 nếu là sản phẩm lỏng) đến thời điểm rót môi trường (5.3) vào đĩa không được vượt quá 15 phút.
Trộn cẩn thận mẫu cấy với môi trường và để cho hỗn hợp đông đặc lại bằng cách đặt đĩa Petri ở một mặt phẳng ngang, mát.
Đồng thời chuẩn bị một đĩa kiểm tra với 15 ml môi trường để kiểm tra độ vô trùng.
9.2.3. Sau khi đông đặc hoàn toàn, rót khoảng 4 ml môi trường VRBL (5.3) ở 450C ± 0,50C lên bề mặt của môi trường vừa cấy. Để cho đông lại như mô tả ở trên.
9.2.4. Lật ngược các đĩa đã cấy và để vào tủ ấm ở 300C, 350C hoặc 370C (theo thỏa thuận) trong 24 h ± 2 h.
9.3. Đếm các khuẩn lạc
Sau thời gian nuôi ấm quy định (xem 9.2.4) dùng thiết bị đếm khuẩn lạc (6.6) để đếm các khuẩn lạc coliform đặc trưng trên mỗi đĩa có chứa không quá 150 khuẩn lạc2) các loại.
Chú thích – Sau khi nuôi 24 h, các khuẩn lạc đặc trưng là những khuẩn lạc màu đỏ ánh tía có đường kính 0,5 mm hoặc lớn hơn và đôi khi có vùng mật tủa hơi đỏ bao quanh.
10. Biểu thị kết quả
10.1. Phương pháp tính
10.1.1. Trường hợp chung – Đối với các đĩa có chứa từ 15 đến 150 khuẩn lạc đặc trưng
Giữ lại các đĩa chứa không quá 150 khuẩn lạc đặc trưng ở hai độ pha loãng kế tiếp nhau. Một trong các đĩa này cần chứa ít nhất là 15 khuẩn lạc đặc trưng.
Tính số coliform N mililit hoặc trên gam sản phẩm, tùy từng trường hợp, dùng công thức sau đây:
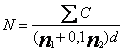
Trong đó
![]() là tổng các khuẩn lạc đặc trưng đếm được trên tất cả các đĩa được chọn;
là tổng các khuẩn lạc đặc trưng đếm được trên tất cả các đĩa được chọn;
n1 là tổng số đĩa được giữ lại trong độ pha loãng thứ nhất;
n2 là tổng số đĩa được giữ lại trong độ pha loãng thứ hai;
d là hệ số pha loãng ứng với độ pha loãng thứ nhất.
Làm tròn kết quả đến hai chữ số có nghĩa.
Kết quả số coliform trên mililit hoặc trên gam sản phẩm được biểu thị bằng một số từ 0,1 đến 9,9 nhân với 10x trong đó x là lũy thừa của 10.
Thí dụ: Đếm coliform ở 300C cho kết quả sau:
– ở độ pha loãng thứ nhất được giữ lại (10-2): 83 và 97 khuẩn lạc đặc trưng
– ở độ pha loãng thứ hai được giự lại (10-3): 13 và 8 khuẩn lạc đặc trưng
![]() =
= ![]()
Làm tròn kết quả theo quy định ở trên thành 9 100 hoặc 9,1x 103 coliform trên mililit hoặc trên gam sản phẩm.
10.1.2. Trường hợp mỗi đĩa có chứa ít hơn 15 khuẩn lạc đặc trưng
Nếu mỗi đĩa giữ lại chứa ít hơn 15 khuẩn lạc đặc trưng, tính số coliform ước lượng NE bằng công thức nêu ở 10.1.1.
Thí dụ: Đếm số coliform ở 300C cho kết quả sau:
– Ở dịch pha loãng 10-4: 140 và 145 khuẩn lạc trong đó có 5 và 3 khuẩn lạc đặc trưng tương ứng.
– Ở dịch pha loãng 10-5 : 11 và 8 khuẩn lạc trong đó có 0 và 1 khuẩn lạc đặc trưng tương ứng. ![]()
![]()
Làm tròn kết quả theo quy định ở 10.1.1 cho kết quả 4,0×104 coliform trên mililit hoặc trên gam.
10.1.3. Ước đoán số lượng nhỏ
Nếu hai đĩa ứng với mẫu thử (sản phẩm lỏng) hoặc huyền phù ban đầu (các sản phẩm ở dạng khác) chứa ít hơn 15 khuẩn lạc đặc trưng thì báo cáo như sau:
– ít hơn 15 coliform trên mililit (sản phẩm lỏng)
– ít hơn 15x 1/d coliform trên gam (các sản phẩm ở dạng khác), trong đó d là hệ số pha loãng của huyền phù ban đầu.
10.1.4. Trường hợp không có khuẩn lạc đặc trưng
– nếu hai đĩa ứng với mẫu thử (sản phẩm lỏng) hoặc huyền phù ban đầu (các sản phẩm ở dạng khác) không chứa khuẩn lạc đặc trưng nào thì báo cáo kết quả thử như sau:
– ít hơn 1 coliform trên mililit (sản phẩm lỏng).
– ít hơn 1 x 1/d coliform trên gam (các sản phẩm ở dạng khác), trong đó d là hệ số pha loãng của huyền phù ban đầu.
10.2. Độ chụm
10.2.1. Các đĩa có chứa từ 15 đến 150 khuẩn lạc đặc trưng (xem 10.1.1)
Vì lý do thuần túy thống kê, 95% trường hợp giới hạn tin cậy của phương pháp dao động từ ± 16% đến ± 52% (Cowel và Morisetti, tạp chí nông nghiệp thực phẩm, tập 20 trang 573). Trên thực tế, sai lệch này thậm chí còn lớn hơn, đặc biệt giữa các kết quả nhận được từ các nhân viên thí nghiệm khác nhau.
10.2.2. Mỗi đĩa chứa ít hơn 15 khuẩn lạc đặc trưng (xem 10.1.2)
Tham khảo bảng A.1 để tính giới hạn tin cậy bằng cách lấy giới hạn dưới và trên nhân với 1/d, trong đó d là hệ số pha loãng.
10.2.3. Ước đoán số lượng nhỏ (xem 10.1.3)
Giới hạn tin cậy đối với việc ước đoán số lượng nhỏ các coliform, cho ở bảng A.1.
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm cần chỉ rõ phương pháp đã sử dụng, mục đích thử (mang tính chất kỹ thuật hay sức khỏe cộng đồng), nhiệt độ được chọn kết quả nhận được. Báo cáo thử nghiệm cũng cần đề cập đến bất kỳ thao tác nào mà không được quy định trong tiêu chuẩn này hoặc những điều được coi là tùy ý cũng như các sự cố có thể ảnh hưởng đến kết quả thử.
Báo cáo thử nghiệm phải bao gồm tất cả các thông tin cần thiết để nhận biết mẫu một cách đầy đủ.
Phụ lục A
(Qui định)
Giới hạn tin cậy để ước đoán số lượng nhỏ khuẩn lạc
Giới hạn tin cậy ở mức 95% đối với việc ước đoán số lượng nhỏ khi số khuẩn lạc ở trên các đĩa được giữ lại ít hơn 15 khuẩn lạc cho ở bảng A.1.
Bảng A.1
|
Số vi sinh vật |
Giới hạn tin cậy ở 95% |
|
|
thấp hơn |
cao hơn |
|
|
1 |
<1 |
2 |
|
2 |
<1 |
4 |
|
3 |
<1 |
5 |
|
4 |
1 |
6 |
|
5 |
2 |
9 |
|
6 |
2 |
10 |
|
7 |
2 |
12 |
|
8 |
3 |
13 |
|
9 |
4 |
14 |
|
10 |
4 |
16 |
|
11 |
5 |
18 |
|
12 |
6 |
19 |
|
13 |
7 |
20 |
|
14 |
7 |
21 |
|
15 |
8 |
23 |
1) Tùy theo sức đông của thạch
2) Cao hơn con số này thì có nguy cơ rằng các khuẩn lạc sẽ không cho hình dạng điển hình



