Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6953:2001 (ISO 14718 : 1998) về Thức ăn chăn nuôi – Xác định hàm lượng aflatoxic B1 trong thức ăn hỗn hợp – Phương pháp sắc ký lỏng hiệu năng cao do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6953 : 2001
ISO 14718 : 1998
THỨC ĂN CHĂN NUÔI – XÁC ĐỊNH HÀM LƯỢNG AFLATOXIN B1 TRONG THỨC ĂN HỖN HỢP – PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO
Animal feeding stuffs – Determination of aflatoxin B1 content of mixed feeding stuffs – Method using high-performance liquid chromatography
Lời nói đầu
TCVN 6953 : 2001 hoàn toàn tương đương với ISO 14718 : 1998.
TCVN 6953 : 2001 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F17 Thức ăn chăn nuôi biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
THỨC ĂN CHĂN NUÔI – XÁC ĐỊNH HÀM LƯỢNG AFLATOXIN B1 TRONG THỨC ĂN HỖN HỢP – PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO
Animal feeding stuffs – Determination of aflatoxin B1 content of mixed feeding stuffs – Method using high-performance liquid chromatography
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp sắc ký lỏng hiệu năng cao (HPLC) để xác định hàm lượng aflatoxin B1 trong thức ăn chăn nuôi bao gồm cả những thức ăn chăn nuôi có chứa bã cam quít.
Giới hạn xác định thấp nhất là 1 mg/kg.
Chú thích 1 – Tiêu chuẩn này có thể áp dụng để xác định hàm lượng aflatoxin B1 của nguyên liệu thô và thức ăn chăn nuôi như gluten ngô, lạc nhân, hạt cọ dầu, cùi dừa khô, bã cam quít, bột tapioca, đậu tương, cám gạo, phấn hoa, hạt cải dầu, hạt bông (xem tài liệu tham khảo [1] và [2]). Tuy nhiên, những loại này không nằm trong thử nghiệm phối hợp của phương pháp.
Chú thích 2 – Tiêu chuẩn này cũng có thể áp dụng để xác định tổng hàm lượng aflatoxin B1, B2, G1 và G2. Tuy nhiên thông số này chưa được khẳng định với phương pháp thử nghiệm phối hợp này.
2. Tiêu chuẩn viện dẫn
TCVN 6952 : 2001 (ISO 6498 : 1998) Thức ăn chăn nuôi – Chuẩn bị mẫu thô
3. Nguyên tắc
Chiết mẫu bằng clorofooc. Phần chiết được lọc và phần dịch lọc được làm sạch trên cột Florisilâ1) và cột C18. Sự xác định và phân tách cuối cùng thu được bằng sắc ký lỏng hiệu năng cao (HPLC) dùng cột C18 pha ngược, dẫn xuất hóa sau cột bằng iốt hoặc brom, sử dụng detector huỳnh quang.
4. Thuốc thử và hóa chất
Chỉ dùng những thuốc thử được công nhận đạt chất lượng phân tích.
4.1. Nước: đã loại khoáng hoặc khử ion, điện trở suất ít nhất là 10 MW cm, hoặc ít nhất nước có độ tinh khiết tương đương.
4.2. Axit sunfuric đậm đặc: c(H2SO4) = 18 mol/l, r(H2SO4) = 1,84 g/ml.
4.3. Axit sunfuric: c(H2SO4) = 2 mol/l.
Thêm từ từ 105 ml axit sunfuric đậm đặc (4.2) vào 895 ml nước, khuấy đều. Tránh làm dung dịch quá nóng.
4.4. Mẫu kiểm tra
Chuẩn bị mẫu kiểm tra gồm khoảng 2 kg thức ăn chăn nuôi có chứa khoảng 5 mg/kg aflatoxin B1 bằng cách trộn đều những mẫu đã xác định trước với 5 mg/kg aflatoxin B1.
Hàm lượng aflatoxin B1 của mẫu kiểm tra do hai người phân tích tiến hành xác định 5 lần theo quy trình mô tả ở điều 8. Từ kết quả hàm lượng aflatoxin B1 trung bình, độ lệch chuẩn và hệ số biến động sẽ được tính toán.
4.5. Celiteâ545 đã được rửa axit, hoặc sản phẩm có chất lượng tương đương2).
4.6. Cột loại Florisilâ Sep-Pak, Waters No.51960, hoặc sản phẩm có chất lượng tương đương3).
4.7. Cột loại Sep-Pak C18, Waters No. 51910, hoặc sản phẩm có chất lượng tương đương3).
4.8. Axeton.
4.9. Metanol.
4.10. Axetonitril.
4.11. Clorofooc, được ổn định với etanol (tỷ lệ khối lượng 0,5 % đến 1%.)
Cảnh báo – Clorofooc là một chất độc. Tránh hít phải và tiếp xúc trực tiếp với clorofooc. Khi làm việc với dung môi và các dung dịch phải tiến hành trong tủ hốt.
Đặc tính hấp phụ của cột Florisilâ (4.6) có thể biến đổi nếu sử dụng chất ổn định không phải là etanol. Nếu không dùng clorofooc, đặc tính hấp phụ phải được kiểm tra theo điều 8.
4.12. Hỗn hợp axeton và nước, theo tỷ lệ 98 : 2 (theo thể tích).
Trộn 980 ml axeton (4.8) với 20 ml nước (4.1). Lắc đều.
4.13. Hỗn hợp axeton và nước, theo tỷ lệ 15 : 85 (theo thể tích).
Trộn 150 ml axeton (4.8) với 850 ml nước (4.1). Lắc đều.
4.14. Hỗn hợp axeton và nước, theo tỷ lệ 5 : 95 (theo thể tích).
Trộn 50 ml axeton (4.8) với 950 ml nước (4.1). Lắc đều.
4.15. Hỗn hợp metanol và nước, theo tỷ lệ 20 : 80 (theo thể tích).
Trộn 200 ml metanol (4.9) với 800 ml nước (4.1). Lắc đều.
4.16. Axit nitric đậm đặc, C(HNO3) = 14 mol/l, r(HNO3) = 1,40 g/ml, HPLC có dẫn xuất brom.
4.17. Kali bromua (KBr), HPLC có dẫn xuất brom.
4.18. Pha động cho HPLC
4.18.1. Pha động cho HPLC với dẫn xuất hóa bằng iốt
Trộn 120 ml axetonitril (4.10) với 210 ml metanol (4.9) và 390 ml nước (4.1), lắc đều. Lọc dung môi rửa giải qua màng lọc PTFE 0,45 mm, sử dụng hệ thống lọc dung môi (5.1) và trước khi dùng, loại khí trong bể siêu âm 10 phút (5.2) trước khi dùng.
Chú thích – Thành phần dung môi pha động có thể cần được điều chỉnh phụ thuộc vào đặc tính của cột HPLC sử dụng.
4.18.2. Pha động cho HPLC với dẫn xuất hóa bằng brom
Trộn 400 ml axetonitril (4.10) với 700 ml metanol (4.9) và 1300 ml nước (4.1), lắc đều. Thêm vào hỗn hợp 286 mg kali bromua (4.17) và 152 ml axit nitric đậm đặc (4.16). Lắc đều và loại khí bằng dòng khí trơ trong 15 phút.
4.19. Dung dịch iốt bão hòa cho HPLC với dẫn xuất hóa bằng iốt
Cho 2 g iốt vào 400 ml nước. Khuấy đều ít nhất trong 90 phút và lọc qua màng lọc PTFE 0,45 mm (xem 5.1). Chuẩn bị dung dịch ngay trong ngày sử dụng.
Bảo vệ dung dịch bão hòa khỏi ánh sáng để tránh hiện tượng quang phân hủy.
4.20. Dung dịch natri hipoclorit, (chất thường dùng) r(clo hoạt tính) = 100 g/l.
4.21. Dung dịch natri hipoclorit, tỷ lệ thể tích 1 %.
Pha 10 ml dung dịch natri hipoclorit (4.20) với 990 ml hỗn hợp nước-axeton (4.14).
4.22. Khí trơ, ví dụ khí nitơ.
4.23. Chất tiêu chuẩn aflatoxin B1 (C17H12O6), 2,3,6aa, 9aa-tetrahydro-4-methoxycyclopenta[c]furo [3′, 2′: 4,5]furo[2,3-h][1]benzopyran-1,11-dione; Cơ quan Đăng ký Những chất chiết dùng cho Hóa học (CAS) số 1162-65-8.
Cảnh báo
1. Mycotoxin là chất cực kỳ độc. Mọi thao tác phải tiến hành trong tủ hốt. Thực hiện các biện pháp phòng ngừa đặc biệt khi chất độc ở dạng khô vì chúng có bản chất tĩnh điện và vì vậy mycotoxin có xu hướng tự phát tán trong môi trường làm việc.
2. Aflatoxin rất nhạy với bức xạ UV. Vì vậy, khi tiến hành mọi thao tác phải tránh ánh sáng mặt trời hoặc ánh sáng trắng nhân tạo. Cần đảm bảo chiếu sáng đầy đủ nhưng không quá chói bằng đèn dây tóc vonfram. Có thể dùng những đèn tỏa nhiệt lượng ít và đèn ống huỳnh quang, nên sử dụng đồ thủy tinh có màu hổ phách (lọ, bình định mức).
3. Những đồ thủy tinh tiếp xúc trực tiếp với dung dịch aflatoxin B1 trước khi rửa phải được ngâm qua đêm trong dung dịch hipoclorit (4.21) để loại bỏ hoàn toàn các vết aflatoxin B1.
4.24. Dung dịch tiêu chuẩn aflatoxin B1, r(aflatoxin B1) » 10 mg/ml.
Cho toàn bộ một ống (ampul) aflatoxin B1 (4.23) vào bình và hòa tan trong clorofooc (4.11). Chuyển dung dịch vào bình định mức có dung tích phù hợp và pha loãng đến vạch bằng clorofooc để thu được một dung dịch có chứa hàm lượng aflatoxin B1 khoảng 10 mg/ml. Lắc đều.
Chuyển dung dịch vào bình có màu hổ phách hoặc chai nút xoáy kín khí và bảo quản ở nơi mát (4oC) trong chỗ tối, được bịt chặt và bọc bằng giấy nhôm.
4.25. Dung dịch tiêu chuẩn gốc aflatoxin B1
Chuyển 2,5 ml dung dịch chuẩn aflatoxin B1 (4.24) vào bình định mức dung tích 50 ml và pha loãng đến vạch bằng clorofooc (4.11).
Chuyển dung dịch vào bình có màu hổ phách hoặc chai nút xoáy, kín khí và bảo quản ở nơi mát (4oC) trong chỗ tối, bình được bịt chặt và bọc bằng giấy nhôm.
4.26. Dung dịch hiệu chuẩn alfatoxin B1 dùng cho HPLC
4.26.1. Dung dịch hiệu chuẩn I, r(aflatoxin B1) » 4 ng/ml.
Để bình định mức bọc giấy nhôm có chứa dung dịch hiệu chuẩn gốc (4.25) đạt nhiệt độ trong phòng (trong vài giờ).
Chuyển 400 ml dung dịch tiêu chuẩn gốc (tương đương khoảng 200 ng aflatoxin B1) vào một bình định mức dung tích 50 ml đã được rửa axit, làm bay hơi dung dịch đến khô bằng dòng khí trơ (4.22). Hòa tan cặn bằng 20 ml hỗn hợp nước-axeton (4.13). Pha loãng đến vạch bằng hỗn hợp nước-axeton và lắc đều.
4.26.2. Dung dịch hiệu chuẩn II, r(aflatoxin B1) » 3 ng/ml
Chuyển 7,5 ml dung dịch hiệu chuẩn I (4.26.1) vào một bình định mức dung tích 10 ml đã được rửa axit. Pha loãng đến vạch bằng hỗn hợp nước-axeton (4.13) và lắc đều.
4.26.3. Dung dịch hiệu chuẩn so sánh, r(aflatoxin B1) » 2 ng/ml
Chuyển 25 ml dung dịch hiệu chuẩn I (4.26.1) vào một bình định mức dung tích 50 ml đã được rửa axit. Pha loãng đến vạch bằng hỗn hợp nước-axeton (4.13) và lắc đều.
Dung dịch này được bơm lặp lại trong quá trình sắc ký. (8.5).
4.26.4. Dung dịch hiệu chuẩn III, r(aflatoxin B1) » 1 ng/ml
Chuyển 2,5 ml dung dịch hiệu chuẩn I (4.26.1) vào một bình định mức dung tích 10 ml đã được rửa axit. Pha loãng đến vạch bằng hỗn hợp nước-axeton (4.13) và lắc đều.
4.27. Dung dịch thử cho sắc ký
Chuẩn bị một ống (ampul) chứa hỗn hợp các aflatoxin B1, B2, G1 và G2 trong 1 ml clorofooc nồng độ tương ứng xấp xỉ là 1,0 mg/ml; 0,5 mg/ml; 1,0 mg/ml và 0,5 mg/ml.
Cho toàn bộ hỗn hợp trong ampul vào một ống nghiệm có nút thủy tinh hoặc vào bình có nắp xoáy. Chuyển 40 ml dung dịch này vào một ống nghiệm có nút thủy tinh đã được rửa axit (5.4). Làm bay hơi clorofooc bằng dòng khí trơ (4.22) và hòa tan cặn bằng 10 ml hỗn hợp nước – axeton (4.13).
5. Thiết bị, dụng cụ
Trước khi dùng, tất cả đồ thủy tinh tiếp xúc trực tiếp với dung dịch aflatoxin phải được ngâm vài giờ trong axit sunfuric (4.3), sau đó rửa sạch (ví dụ 3 lần) bằng nước để loại bỏ hoàn toàn axit. Kiểm tra tồn dư của axit bằng giấy pH.
Trong thực tế khâu xử lý này rất cần thiết đối với bình đáy tròn của thiết bị cất quay (5.12), các bình định mức, xylanh đo, các bình hoặc ống nghiệm dùng để đựng dung dịch xây dựng đường chuẩn và dịch chiết cuối cùng (đặc biệt bình lấy mẫu tự động) và pipet Pasteur, nếu những dụng cụ này dùng để chuyển dung dịch đường chuẩn hoặc dịch chiết.
Chú thích – Những dụng cụ thủy tinh dùng trong phòng thí nghiệm tiếp xúc trực tiếp với dung dịch aflatoxin phải được ngâm trong axit loãng vì nếu sử dụng những dụng cụ thủy tinh không được ngâm axit có thể làm tổn thất aflatoxin B1. Phải đặc biệt chú ý đến những dụng cụ thủy tinh mới và những dụng cụ thủy tinh đã sử dụng như bình lấy mẫu tự động và pipét Pasteur.
Sử dụng những thiết bị dùng trong phòng thí nghiệm sau:
5.1. Hệ thống lọc dung môi, phù hợp với màng lọc PTFE có kích thước lỗ 0,45 mm.
5.2. Bể siêu âm.
5.3. Micro si-ranh, dung tích 100 ml dùng cho chuẩn bị dung dịch đường chuẩn.
Kiểm tra bằng cách cân và độ không chính xác không vượt quá 2 % khối lượng.
5.4. Ống thủy tinh chuẩn có nắp, dung tích 10 ml.
5.5. Phổ kế, phù hợp với các phép đo trong vùng UV của phổ, gồm các cuvét thạch anh có chiều dài đường quang học là 10 mm ± 0,1 mm.
5.6. Bình tam giác, dung tích 500 ml, được làm từ thủy tinh borosilicat, cổ bình rộng và có nút thủy tinh hoặc nút xoáy có lót PTFE.
5.7. Máy lắc cơ, lắc theo chiều ngang hoặc chuyển động tịnh tiến với tần số 250 – 300 vòng/phút.
5.8. Giấy lọc gấp nếp, đường kính 24 cm.
5.9. Van đóng ba chạc Luerâ bền với clorofooc4).
5.10. Siranh bền về mặt hóa học, dung tích 10 ml có các ống nối Luerâ 4).
5.11. Cột thủy tinh, có đường kính trong từ 10 – 15 mm, chiều dài khoảng 30 – 50 cm , có nút Luerâ 4).
Chú thích – Nếu sử dụng cột thủy tinh có đường kính trong khoảng 10 mm và dài khoảng 30 cm, thì nên dùng bể chứa bằng nhựa (bền về mặt hóa học) ít nhất có dung tích 70 ml.
5.12. Thiết bị cất quay chân không, có bình đáy tròn dung tích 150 – 250 ml.
5.13. Hệ thống HPLC
Xem hình 1 và 2 giới thiệu sơ đồ hệ thống HPLC cho dẫn xuất hóa bằng iốt và brom, tương ứng.
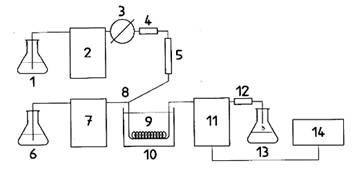
|
1. Pha động trong HPLC 2. Bơm HPLC 3. Bơm nạp mẫu 4. Cột bảo vệ 5. Cột phân tích 6. Dung dịch iốt bão hòa 7. Bơm dung môi 8. Ống nối chữ T 9. Nồi cách thủy (60oC) |
10. Cuộn dây phản ứng 11. Detector huỳnh quang 12. Điện trở 13. Bình chứa dung môi thải 14. Thiết bị ghi/tích phân 15. Ngăn dẫn xuất (KOBRAâ) 16. Vôn kế 17. Nguồn điện, 10 V d.c 18. Điện trở, 100 kW |
Hình 1 – Sơ đồ giới thiệu hệ thống HPLC cho dẫn xuất hóa bằng iốt
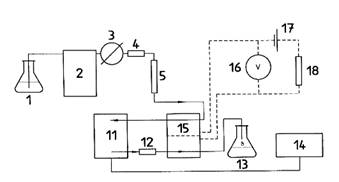
Hình 2 – Sơ đồ giới thiệu hệ thống HPLC cho dẫn xuất hóa bằng brom (xem ghi chú ở sơ đồ 1)
5.13.1. Bơm, phải ổn định, có khả năng duy trì tốc độ dòng trong khoảng 0,1 ml/phút đến 1,0 ml/phút.
5.13.2. Bơm nạp mẫu, có vòng nạp mẫu phù hợp với lượng nạp mẫu là 250 ml.
5.13.3. Detector huỳnh quang, kích thước ở bước sóng 365 nm và phát ra ở bước sóng 435 nm (đối với thiết bị lọc có bước sóng phát ra > 400 nm). Có khả năng phát hiện được nồng độ aflatoxin B1 thấp nhất là 0,05 ng. Có thể dùng áp lực ngược (ví dụ bằng cách dùng của một điện trở hoặc một lõi thép không gỉ hoặc polytetrafluoetylen (PTFE) nối với đầu ra của detector) để loại bọt khí trong dòng chảy.
5.13.4. Máy ghi
5.13.5. Cột bảo vệ, dùng cột C18 có kích thước hạt nhồi từ 37 – 50 mm, dài 10 – 20 mm, đường kính trong 3,9 mm; hoặc dùng một cột bảo vệ khác có chất lượng tương đương.
5.13.6. Cột phân tích, dùng cột C18 có kích thước hạt nhồi từ 3 – 5 mm, dài 200 mm, đường kính trong 3,0 mm; hoặc dùng một cột bảo vệ khác có chất lượng tương đương.
5.13.7. Bộ tích phân điện tử (tùy chọn).
5.14. Hệ thống HPLC đối với HPLC với dẫn xuất hóa bằng iốt
5.14.1. Bơm, phải ổn định, cung cấp thuốc thử iốt cột cuối.
5.14.2. Van chữ T có vùng thể tích chết bằng không, bằng thép không gỉ kích thước 1,59 mm x 0,75 mm.
5.14.3. Cuộn dây phản ứng hình xoắn ốc, bằng polytetrafluoetylen (PTFE) hoặc thép không gỉ.
Thực tế cho thấy kích thước 3000 mm x 0,5 mm đến 5000 mm x 0,5 mm phù hợp với cột HPLC có kích thước 5 mm hoặc 3 mm.
5.14.4. Bồn nước được điều nhiệt hoặc tủ ấm, được điều chỉnh đến 60oC, có thể chỉnh nhiệt độ chính xác đến 0,1oC.
5.15. Hệ thống HPLC đối với HPLC với dẫn xuất hóa bằng brom
5.15.1. Ngăn điện hóa, thiết bị brom của Kok (KOBRAâ5)).
5.15.2. Nguồn điện, 0 V đến 20 V một chiều.
5.15.3. Dụng cụ đo, dải đo từ 0 V đến 10 V một chiều, trở kháng > 50 kW.
5.15.4. Điện trở, 100 kW.
5.16. Xi-lanh, thích hợp cho HPLC với lượng mẫu đưa vào 250 ml.
6. Lấy mẫu
Phương pháp lấy mẫu không quy định trong tiêu chuẩn này. Nên lấy mẫu theo ISO 6497 [7].
Điều quan trọng là phòng thí nghiệm phải nhận được mẫu có tính đại diện và trung thực, không bị hư hại hoặc bị thay đổi trong quá trình vận chuyển và bảo quản.
7. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6952 : 2001 (ISO 6498).
Mẫu phòng thí nghiệm được nghiền (thường 500 g) sao cho hoàn toàn lọt qua sàng có đường kính lỗ sàng 1 mm. Trộn đều.
8. Cách tiến hành
8.1. Khái quát
Đối với mỗi lần đo thêm vào mẫu trắng 10 mg/kg aflatoxin B1 và hóa chất đã được chứng nhận hoặc một mẫu kiểm tra (4.4). Thêm vào mẫu trắng các hóa chất để kiểm tra sự nhiễm bẩn từ dụng cụ thủy tinh.
Kết quả đưa ra sẽ phải phù hợp với quy định tại điều 10.
8.2. Xác định phổ hấp thụ của dung dịch tiêu chuẩn aflatoxin B1
Xác định phổ hấp thụ dung dịch tiêu chuẩn aflatoxin B1 (4.24) trong cuvét trong khoảng bước sóng 330 nm và 370 nm bằng phổ kế (5.5), lấy clorofooc làm mẫu trắng. Đo độ hấp thụ (A) ở bước sóng 363 nm – gần bước sóng cực đại.
8.3. Chiết
Cân 50,0 g (chính xác đến 0,1 g) mẫu thử đã chuẩn bị (xem điều 7) cho vào bình tam giác (5.6). Thêm lần lượt 25 g Celiteâ (4.5), 250 ml clorofooc (4.11) và 25 ml nước. Để bình cố định, khuấy nhẹ và giải phóng áp suất. Đặt bình vào máy lắc cơ (5.7) và lắc trong 30 phút.
Chú thích – Để giảm thể tích clorofooc sử dụng, có thể dùng một nửa lượng nói trên, nghĩa là 25,0 g mẫu thử đã chuẩn bị (xem điều 7), 12,5 g Celiteâ (4.5), 125 ml clorofooc (4.11) và 12,5 ml nước.
Lọc qua giấy lọc gấp nếp (5.8). Nếu quá trình lọc diễn ra chậm, phải bọc toàn bộ phễu để tránh hiện tượng bay hơi clorofooc. Thu 50 ml dịch lọc (Vs).
Nếu cần lấy một phần dịch và pha loãng thành 50 ml (Vf) bằng clorofooc để lượng aflatoxin B1 không vượt quá 4 ng/ml.
Dùng dịch lọc của mẫu đã làm sạch theo 8.4.
8.4. Làm sạch
Thực hiện các quá trình liên tục.
8.4.1. Làm sạch Florisilâ
8.4.1.1. Chuẩn bị cột làm sạch
Gắn van ba chạc (5.9) vào cuối cột Florisilâ (4.6). Rửa cột và loại không khí bằng cách lấy 10 ml clorofooc (4.11) và cho nhanh 8 ml qua van và dùng si-ranh (5.10) bơm clorofooc vào cột.
Gắn vào phần dài hơn của cột thủy tinh (5.11) và cho nốt 2 ml clorofooc còn lại qua cột. Khóa van. Bỏ si-ranh ra.
8.4.1.2. Làm sạch
Cho dịch lọc thu được (Vs hoặc Vf) ở 8.3 vào dãy cột và để tự chảy dưới tác dụng của trọng lực. Rửa bằng 5 ml clorofooc (4.11), rửa tiếp bằng 20 ml metanol (4.9), gạn phần dung môi rửa giải ra.
Trong quá trình này phải đảm bảo dãy cột không bị khô.
Rửa giải aflatoxin B1 bằng 50 ml hỗn hợp axeton – nước (4.12) và thu chất rửa giải vào bình đáy tròn của thiết bị cất quay (5.12).
Chú thích 1 – Chất lượng cột Florisilâ thay đổi ở từng đợt. Phụ thuộc vào chất lượng này nên 50 ml hỗn hợp axeton – nước (4.12) có thể không đủ để rửa giải. Nếu trường hợp này xảy ra dùng 60 ml đến 70 ml hỗn hợp axeton – nước (4.12).
Cô đặc phần dung môi rửa giải trên thiết bị cất quay trong khoảng nhiệt độ 40oC – 50oC đến khi không còn axeton.
Chú thích 2 – Lúc này trong bình còn khoảng 0,5 ml chất lỏng. Các thực nghiệm đã cho thấy việc cho bay hơn thêm là không có hại và khi đó còn lại khoảng 0,5 ml chất lỏng, và lúc này không còn axeton. Các vết axeton có thể làm giảm aflatoxin B1 trong cột C18.
Thêm 1 ml metanol (4.9), khuấy để hòa tan aflatoxin B1 bám ở bình, thêm 4 ml nước và khuấy đều. Tháo và bỏ cột ra. Rửa cột thủy tinh bằng nước và những phần tử còn lại ở bước làm sạch cột C18.
8.4.2. Làm sạch bằng cột C18
8.4.2.1. Chuẩn bị dãy cột
Gắn van ba chạc (5.9) vào phía cuối cột C18 (4.7). Rửa cột và loại không khí bằng cách dùng si-ranh (5.10) bơm nhanh 10 ml metanol (4.9) vào cột. Có thể nhận thấy các bọt khí trong cột như những điểm sáng trong nền hơi xám. Lấy 10 ml nước và cho qua cột 8 ml nước. Tránh đưa không khí vào trong cột khi chuyển từ metanol sang nước.
Gắn vào phần dài hơn của cột thủy tinh (5.11) và cho nốt 2 ml nước còn lại qua cột. Khóa van, Bỏ si-ranh ra.
8.4.2.2. Làm sạch
Cho phần chiết được ở 8.4.1.2 vào cột thủy tinh (5.11), rửa bình hai lần bằng 5 ml hỗn hợp nước-metanol (4.15) và để chảy do tác dụng của trọng lực.
Trong quá trình này, đảm bảo rằng dãy cột không bị khô. Nếu thấy xuất hiện bọt khí ở chỗ thắt, dừng dòng chảy và mở vòi ở đỉnh cột thủy tinh để loại bỏ bọt khí. Sau đó lại tiếp tục quá trình.
Rửa giải bằng 25ml hỗn hợp nước – metanol (4.15). Lấy phần dung môi rửa giải ra. Rửa giải aflatoxin B1 bằng 25 ml hỗn hợp nước – axeton (4.13) và thu phần dung môi rửa giải vào bình định mức dung tích 50 ml. Pha loãng đến vạch bằng nước và lắc đều. Dùng dung dịch này cho phần sắc ký (8.5).
Chú thích – Thông thường lọc phần dịch chiết cuối cùng trước khi đưa vào HPLC là không cần thiết. Nếu thấy cần xem xét không được lọc qua xenlulô vì sẽ làm giảm lượng aflatoxin B1. Nên dùng màng lọc PTFE.
8.5. Sắc ký lỏng hiệu năng cao
8.5.1. Khái quát
Phải có đủ thời gian chuẩn bị và ổn định thiết bị.
Tốc độ dòng của pha động và chất thử sau cột đã được xác định. Chúng được điều chỉnh phụ thuộc vào đặc điểm của cột HPLC.
Kết quả phát hiện aflatoxin B1 của detector phụ thuộc vào nhiệt độ, do vậy cần phải hiệu chỉnh sự chênh lệch này.
Bằng việc nạp một lượng dung dịch hiệu chuẩn xác định (4.26.3) tại những khoảng xác định (ví dụ ở mỗi lần nạp thứ ba) các giá trị của pic aflatoxin B1 nên được hiệu chỉnh bằng cách lấy giá trị trung bình, để khẳng định sự khác nhau giữa các lần đo liên tiếp dung dịch hiệu chuẩn là rất nhỏ (< 10=”” %).=”” do=”” vậy=”” các=”” lần=”” nạp=”” phải=”” được=”” tiến=”” hành=”” liên=”” tục.=”” nếu=”” cần=”” có=”” sự=”” gián=”” đoạn,=”” lần=”” nạp=”” cuối=”” cùng=”” trước=”” khi=”” dừng=”” và=”” lần=”” nạp=”” đầu=”” tiên=”” sau=”” khi=”” dừng=”” phải=”” là=”” dung=”” dịch=”” hiệu=”” chuẩn=””>
Do đường cong chuẩn là đường thẳng và đi qua gốc nên lượng aflatoxin B1 trong mẫu chiết được xác định trực tiếp bằng cách so sánh kết quả thu được với dung dịch hiệu chuẩn gần kề.
8.5.2. Đặt chế độ nạp cho HPLC
Đặt chế độ nạp (5.13.1) để có tốc độ dòng chảy của pha động (4.18) là 0,5 ml/phút hoặc 0,3 ml/phút với cột HPLC có kích thước hạt là 5 mm hoặc 3 mm tương ứng.
Nếu dùng dẫn xuất hóa bằng iốt, làm theo 8.5.3.
Nếu dùng dẫn xuất hóa bằng brom, làm theo 8.5.4.
8.5.3. Đặt chế độ nạp sau cột cho HPLC với dẫn xuất hóa bằng iốt
Đặt chế độ bơm (5.14.1) để có tốc độ dòng của dung dịch iốt bão hòa (4.19) nằm trong khoảng 0,2 ml/phút đến 0,4 ml/phút. Nên đặt tốc độ dòng khoảng 0,4 ml/phút hoặc 0,2 ml/phút tương ứng với tốc độ dòng của pha động (4.18) là 0,5 ml/phút và 0,3 ml/phút.
8.5.4. Detector huỳnh quang
Dùng detector huỳnh quang (5.13.3) với bước sóng kích thích là 365 nm và bước sóng truyền là 435 nm (đối với thiết bị lọc có bước sóng phát ra > 400 nm). Điều chỉnh bộ suy giảm của detector để phát hiện được khoảng 80 % đối với 1 ng aflatoxin B1.
8.5.5. Nạp
Đối với mọi dung dịch, thể tích nạp là 250 ml theo hướng dẫn của nhà sản xuất.
8.5.6. Kiểm tra sự phân tách của sắc ký
Nạp dung dịch thử sắc ký (4.27). Những phần lõm xuống phải nhỏ hơn 5 % tổng chiều cao các pic liền kề.
8.5.7. Kiểm tra tính ổn định của hệ thống
Trước mỗi lần phân tích, nạp liên tục các dung dịch hiệu chuẩn (4.26.3) đến khi thu được chiều cao pic ổn định. Các pic aflatoxin B1 giữa các lần nạp liên tiếp không khác nhau quá 6%. Tiến hành kiểm tra ngay độ tuyến tính (8.5.8).
8.5.8. Kiểm tra độ tuyến tính
Nạp các dung dịch hiệu chuẩn aflatoxin B1 (4.26.1 đến 4.26.4). Mỗi lần nạp thứ ba dùng dung dịch hiệu chuẩn (4.26.3) để hiệu chỉnh sự chênh lệch kết quả. Các pic của dung dịch hiệu chuẩn không được khác nhau quá 10 % trong 90 phút. Hiệu chỉnh sự chênh lệch theo công thức ở 9.3.
Biểu đồ chuẩn là một đường thẳng và đi qua gốc tọa độ. Các giá trị thu được không khác nhau quá 3% các giá trị danh định.
Nếu các yêu cầu này được thỏa mãn tiến hành quá trình phân tích ngay. Và ngược lại nếu chưa thỏa mãn, phải xác định và hiệu chỉnh nguồn gốc của các nguyên nhân trước khi làm các bước tiếp theo.
8.5.9. Nạp mẫu chiết
Nạp liên tiếp dung dịch hiệu chuẩn (4.26.3), dịch chiết thức ăn chăn nuôi không có aflatoxin B1, dịch chiết thức ăn chăn nuôi có aflatoxin B1, dung dịch hiệu chuẩn (4.26.3), dịch chiết chất so sánh được công nhận hoặc mẫu kiểm tra (4.4) và dung dịch hiệu chuẩn (4.26.3).
Nạp dịch chiết mẫu đã được làm sạch (8.4.2.2). Cứ sau khi nạp hai mẫu dịch chiết, nạp lại dung dịch hiệu chuẩn (4.26.3). Khi đã nạp trên 10 mẫu, các lần nạp cuối cùng là các dung dịch hiệu chuẩn aflatoxin B1 (4.26.1 đến 4.26.4).
9. Tính toán kết quả
9.1. Tính lượng aflatoxin B1 của dung dịch hiệu chuẩn aflatoxin B1
Hàm lượng aflatoxin B1 của dung dịch hiệu chuẩn aflatoxin B1 được tính theo công thức:
![]()
trong đó
|
p |
là hàm lượng aflatoxin B1 của dung dịch tiêu chuẩn aflatoxin B1 (4.24), tính bằng miligam trên mililít; |
|
M |
là khối lượng phân tử gam của aflatoxin B1, (M = 312 g/mol), tính bằng gam trên mol; |
|
A |
là độ hấp thụ đo ở 8.2, được hiệu chỉnh với mẫu trắng; |
|
d |
là chiều dài đường quang của cuvét, (d = 1 cm), tính bằng centimét; |
|
k |
là hệ số hấp thụ phân tử gam của aflatoxin B1 trong clorofooc ở bước sóng 363 nm, l.mol-1.cm-1 (k = 22 300 l.mol-1.cm-1). |
9.2. Tính lượng aflatoxin B1 trong dung dịch hiệu chuẩn được nạp vào
Hàm lượng aflatoxin B1 trong dung dịch hiệu chuẩn (4.26.3) được nạp vào tính theo công thức:
mc = f x p x Vic
trong đó
|
mc |
là hàm lượng aflatoxin B1 trong dung dịch hiệu chuẩn (4.26.3) được nạp vào, tính bằng nanogam; |
|
f |
là hệ số pha loãng và hiệu chỉnh đơn vị, (f = 200 ng/mg) tính bằng nanogam trên miligam; |
|
p |
là hàm lượng aflatoxin B1 của dung dịch tiêu chuẩn aflatoxin B1 (4.24), được tính trong 9.1, tính bằng nanogam trên mililit; |
|
Vic |
là thể tích dung dịch hiệu chuẩn (4.26.3) được nạp, (Vic = 0,25 ml), tính bằng mililit. |
9.3. Tính hàm lượng aflatoxin B1 trong dung dịch thử
Hàm lượng aflatoxin B1 trong dung dịch thử được tính theo công thức:
![]()
trong đó
|
ma |
là hàm lượng flatoxin B1 trong dung dịch thử, tính bằng nanogam; |
|
As |
là diện tích pic ứng với hàm lượng aflatoxin B1 trong dung dịch thử, đơn vị diện tích; |
|
mc |
là hàm lượng aflatoxin B1 trong dung dịch hiệu chuẩn (4.26.3) được nạp, được tính theo 9.2, tính bằng nanogam; |
|
Ac1 |
là diện tích pic ứng với hàm lượng aflatoxin B1 thu được trước khi nạp dung dịch hiệu chuẩn (4.26.3), đơn vị diện tích; |
|
Ac2 |
là diện tích pic ứng với hàm lượng aflatoxin B1 thu được sau khi nạp dung dịch hiệu chuẩn (4.26.3), đơn vị diện tích. |
Chú thích – Có thể dùng chiều cao pic (tính theo đơn vị đo chiều dài) thay cho diện tích pic.
9.4. Tính hàm lượng aflatoxin B1 trong mẫu
Hàm lượng aflatoxin B1 có trong mẫu thử được tính theo công thức:
![]()
trong đó
|
wa |
là hàm lượng aflatoxin B1 có trong mẫu thử, tính bằng microgam trên kilogam; |
|
ma |
là hàm lượng aflatoxin B1 trong dung dịch thử, tính bằng nanogam; |
|
Vs |
là thể tích dịch chiết mẫu không pha loãng thu được ở 8.3 được dùng ở quá trình tiếp theo, (Vs = 50 ml nếu không cần pha loãng dịch lọc thu được ở 8.3), tính bằng mililit; |
|
ms |
là lượng mẫu thử, (ms = 50,0 g), tính bằng gam; |
|
Vis |
là thể tích dịch chiết mẫu được nạp (8.5.8), (Vis = 0,25 ml), tính bằng mililt; |
|
Vf |
là thể tích dịch lọc sử dụng cho làm sạch (8.4), (Vf = 50 ml), tính bằng mililit; |
|
Vc |
là thể tích clorofooc sử dụng để chiết mẫu (xem 8.3), (Vc = 250 ml), tính bằng mililit. |
Nếu ms = 50,0 g , Vs = 50 ml, Vis = 0,25 ml, Vf = 50 ml và Vc = 250 ml công thức sẽ trở thành:
wa = 20 g-1 x ma
10. Độ chụm
10.1. Sai số hệ thống
Thẩm định việc áp dụng đúng phương pháp bằng cách tiến hành lặp lại các phép đo trên những chất chuẩn đã được chứng nhận hoặc trên các mẫu kiểm tra. Nếu chúng không phù hợp, thẩm tra phương pháp bằng những thực nghiệm trên các mẫu trắng bổ sung. Độ lệnh trung bình so với giá trị thực tế được biểu diễn bằng phần trăm của giá trị thực không được nằm ngoài khoảng (- 20% đến + 10%).
10.2. Độ chụm
10.2.1. Thử nghiệm liên phòng thí nghiệm
Thông tin chi tiết các thử nghiệm liên phòng thí nghiệm về độ chụm của phương pháp được tóm tắt trong phụ lục A. Các giá trị này không áp dụng với những dải nồng độ hoặc thành phần với những dải nồng độ hoặc thành phần đã cho.
Phụ lục B tóm tắt các kết quả thống kê của thử nghiệm liên phòng thí nghiệm về đương lượng của dẫn xuất hóa iốt và brom.
10.2.2. Độ lặp lại
Sự chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn độc lập do cùng một kiểm nghiệm viên thực hiện trên cùng một phương pháp đối với cùng mẫu kiểm tra trên cùng một thiết bị và trong cùng một phòng thí nghiệm sẽ không có trên 5% trường hợp vượt giới hạn lặp lại (r) được tính theo công thức:
r = 0,37 mg/kg + 0,19 ![]() (wa £ 15 mg/kg)
(wa £ 15 mg/kg)
trong đó
![]() là giá trị trung bình của hai kết quả, mg/kg;
là giá trị trung bình của hai kết quả, mg/kg;
r là giới hạn lặp lại, mg/kg.
10.2.3. Độ tái lập
Sự chênh lệch tuyệt đối giữa hai kết quả thử nghiệm của các kiểm nghiệm viên khi áp dụng cùng một phương pháp đối với mẫu kiểm tra trên thiết bị khác nhau và ở các phòng thí nghiệm khác nhau sẽ không có trên 5% trường hợp vượt giới hạn lặp lại (R) được tính theo công thức sau:
r = 0,67 mg/kg + 0,33 ![]() (wa £ 15 mg/kg)
(wa £ 15 mg/kg)
trong đó
R là giới hạn tái lập, mg/kg.
![]() là giá trị trung bình của hai kết quả, mg/kg;
là giá trị trung bình của hai kết quả, mg/kg;
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải thể hiện:
– tất cả những thông tin cần thiết để nhận biết đầy đủ về mẫu;
– phương pháp lấy mẫu, nếu biết;
– phương pháp thử đã áp dụng, viện dẫn theo tiêu chuẩn này;
– mọi chi tiết tiến hành không quy định trong tiêu chuẩn hoặc được phép lựa chọn cùng với các chi tiết của bất kỳ yếu tố nào có thể ảnh hưởng đến kết quả;
– kết quả thử nghiệm thu được;
– hoặc nếu đã kiểm tra độ lặp lại, ghi cả kết quả cuối cùng.
PHỤ LỤC A
(tham khảo)
KẾT QUẢ THỬ NGHIỆM LIÊN PHÒNG THỬ NGHIỆM
Độ chụm của phương pháp được xây dựng trên kết quả thử nghiệm liên phòng thí nghiệm tiến hành theo TCVN 6910-2 : 2001 (ISO 5725-2 : 1994) [6]. Có 22 phòng thí nghiệm từ 11 quốc gia thành viên EU tham gia thử nghiệm. Nghiên cứu trên 6 mẫu không biết trước, gồm cả những mẫu thức ăn chăn nuôi có hàm lượng aflatoxin B1 < 2=””>mg /kg và 14 mg /kg.
Bảng A.1 – Kết quả thống kê thử nghiệm liên phòng thí nghiệm áp dụng phương pháp dẫn xuất iốt
|
Thông số |
Mẫu a) |
||
|
1 |
2 |
3 |
|
|
Số phòng thí nghiệm được chọn *) |
15 |
15 |
15 |
|
Hàm lượng aflatoxin B1, trung bình, g/kg |
0,8 |
7,0 |
12,6 |
|
Độ lệch chuẩn lặp lại (sr), mg/kg |
0,20 |
0,44 |
1,20 |
|
Hệ số biến động lặp lại, % |
25,0 |
6,3 |
9,5 |
|
Giới hạn lặp lại (r) [r = 2,8 x sr], mg/kg |
0,55 |
1,24 |
3,37 |
|
Độ lệch chuẩn tái lập (sR), mg/kg |
0,34 |
1,02 |
1,80 |
|
Hệ số biến động tái lập, % |
42,5 |
14,6 |
14,3 |
|
Giới hạn tái lập (R) [R = 2,8 x sR], mg/kg |
0,95 |
2,86 |
5,05 |
|
a) Mẫu 1: Mẫu trắng, hàm lượng aflatoxin B1 < 2=””>mg/kg; gồm: 10 % đại mạch, 20 % sắn, 15 % bã cam, 20 % đậu tương có protein cao, 10 % mật rỉ đường, 20 % thức ăn gia súc viên cho bò, 1,7 % chất béo, 1,5 % dianxi phốtphát và 0,7 % muối. Mẫu 2: Hàm lượng aflatoxin B1 = 8 mg/kg, các thành phần khác giống mẫu 1. Mẫu 3: Hàm lượng aflatoxin B1 = 14 mg/kg, các thành phần khác giống mẫu 1. *) Số phòng thí nghiệm được chọn không tính phòng thí nghiệm đã bị loại. |
|||
Chú thích – Trong báo cáo kết quả của các phòng thí nghiệm (xem tham khảo 3), các giá trị r và R (xem bảng A.2) được rút ra từ bảng A.1. Sự sai khác là các kết quả tính toán có được bằng cách lấy logarit những kết quả đo và việc áp dụng các định nghĩa độ lệch chuẩn r và R. Trong bảng A.2, r là tỷ số giữa hai kết quả lớn nhất của cùng một mẫu được tiến hành trong cùng một phòng thí nghiệm và ở cùng một điều kiện. R được định nghĩa tương tự trong việc so sánh sự khác nhau giữa 2 hai phòng thí nghiệm.
Bảng A.2 – Tóm tắt kết quả thống kê thử nghiệm liên phòng thí nghiệm đã công bố
|
Hàm lượng aflatoxin B1 (mg/kg) |
r (mg/kg) |
R (mg/kg) |
Hệ số biến động lặp lại (%) |
Hệ số biến động tái lập (%) |
|
8 và 14 |
1,4 |
1,7 |
11 |
18 |
PHỤ LỤC B
(tham khảo)
ĐƯƠNG LƯỢNG DẪN XUẤT HÓA IỐT VÀ DẪN XUẤT HÓA BROM
Đương lượng dẫn xuất hóa iốt và dẫn xuất hóa brom có thể suy luận từ số liệu công bố (xem tham khảo 3 và 4). Hơn nữa đương lượng được thấy rõ qua các số liệu do KDLL tập hợp (Kwaliteisdienst Landbouwkundige Laboratoria: Ban Chất lượng Phòng thí nghiệm Nông nghiệp, Hà Lan) trong giai đoạn từ tháng 10/1992 đến tháng 7/1994. Trong giai đoạn này các phòng thí nghiệm đều tiến hành theo hai phương pháp dẫn xuất trên các mẫu có thành phần khác nhau và các thức ăn chăn nuôi có hàm lượng aflatoxin B1 trong khoảng từ 2 mg/kg đến 90 mg/kg. Các kết quả thử nghiệm này nằm trong bảng B.1.
Bảng B.1 – Kết quả thống kê các thí nghiệm về sự đương lượng giữa dẫn xuất hóa iốt và dẫn xuất hóa brom
|
Mẫu |
Dẫn xuất hóa iốt a |
Dẫn xuất hóa brom a |
Mức ý nghĩa b |
||||
|
|
n |
s |
|
n |
s |
||
|
Thức ăn cho bò (dạng viên) |
2,1 2,2 2,2 2,3 4,5 4,7 5,0 5,1 8,3 9,6 10,8 12,1 |
4 4 6 6 3 3 6 6 5 5 6 6 |
0,4 0,3 0,5 0,5 0,2 0,2 0,8 0,7 1,6 1,1 1,6 1,4 |
2,1 2,2 1,9 2,0 4,8 4,7 5,4 5,4 9,0 10,1 9,5 11,8 |
8 8 11 11 8 8 11 11 10 10 9 9 |
0,3 0,3 0,3 0,4 0,4 0,5 0,9 0,8 1,0 1,7 1,6 1,8 |
n.s n.s n.s n.s n.s n.s n.s n.s n.s n.s n.s n.s |
|
Gluten ngô |
16,3 17,6 |
6 6 |
2,3 2,4 |
16,4 18,9 |
11 11 |
2,0 1,5 |
n.s n.s |
|
Cùi dừa khô |
19,7 20,2 27,9 29,0 |
6 6 4 4 |
4,4 3,1 3,4 3,1 |
17,7 18,6 29,3 33,2 |
8 8 8 8 |
2,7 2,3 1,6 1,7 |
n.s n.s n.s p < -=””> |
|
Nhân hạt cọ dầu và lạc |
38,1 53,7 |
6 6 |
7,4 10,7 |
35,3 48,7 |
11 11 |
5,3 7,3 |
n.s n.s |
|
Lạc |
82,0 83,0 |
4 4 |
4,1 9,9 |
84,4 86,0 |
7 7 |
7,1 10,7 |
n.s n.s |
|
Lạc và cơm dừa khô |
80,0 85,5 |
4 4 |
5,5 9,2 |
86,1 94,1 |
9 9 |
7,3 9,3 |
n.s n.s |
|
a) wa là hàm lượng aflatoxin B1 trung bình, mg/kg; n là số kết quả; s là độ lệch chuẩn. b) n.s là không có ý nghĩa thống kê theo Student t-test, iốt được thử nghiệm dựa theo brom. |
|||||||
TÀI LIỆU THAM KHẢO
1. Traag W.A., van Trijp J.M.P., Tuinstra L.G.M.Th. và Kok W.Th Làm sạch mẫu và dẫn xuất sau cột để xác định aflatoxin B1 trong thức ăn chăn nuôi bằng sắc ký lỏng. J. Chrom., 396, pp. 389-394 (1987).
2. RIKILT-DLO, SOP A0446, Viện Kiểm tra các Sản phẩm Nông nghiệp Quốc gia, Ban Nghiên cứu Nông nghiệp (DLO), Grondstoffen voor veevoeder. Xác định trực tiếp aflatoxin B1 – Sắc ký lỏng phân giải cao – Dẫn xuất sau cột – Phát hiện bằng detector huỳnh quang (Xác định trực tiếp aflatoxin B1 trong thức ăn chăn nuôi bằng sắc ký lỏng phân giải cao và dùng detector huỳnh quang).
3. Van Egmond H.P., Heisterkamp S.H và Paulsch W.E. EC-Cộng tác nghiên cứu xác định aflatoxin B1 trong thức ăn chăn nuôi. Phụ gia thực phẩm và các Chất nhiễm bẩn, 8, pp.17-29 (1991).
4. Van Egmond H.P. Patel S., Paulsch W.E., Sizoo E.A. Tuinstra L.G.M.Th., Wood G., Boenke A., Schurer B, và Wagstaffe P.J. Xây dựng 5 nguyên liệu tham khảo dùng làm thức ăn chăn nuôi, xác định trước hàm lượng aflatoxin B1 của chúng. Phụ gia thực phẩm và các Chất nhiễm bẩn, 11, pp.449-477 (1994).
5. TCVN 6910-1 : 2001 (ISO 5725-1 : 1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo.
Phần 1: Nguyên tắc và định nghĩa chung.
6. TCVN 6910-2 : 2001 (ISO 5725-2 : 1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo.
Phần 2: Phương pháp cơ bản để xác định độ lặp lại và độ tái lặp của phương pháp đo tiêu chuẩn.
7. ISO 6497 Thức ăn chăn nuôi Lấy mẫu (Animal feeding stuffs – Sampling).
8. TCVN 6599 : 2000 (ISO 6651) Thức ăn chăn nuôi Xác định hàm lượng aflatoxin B1 (Phương pháp TLC).
1) Florisilâ là tên thương mại của sản phẩm. Thông tin rất tiện lợi cho người sử dụng tiêu chuẩn này nhưng không phải là sự xác nhận của ISO đối với sản phẩm này. Những sản phẩm tương đương có thể được sử dụng nếu chúng cho những kết quả tương tự.
2) Celiteâ là tên thương mại của sản phẩm.
3) Florisilâ là tên thương mại của sản phẩm. Loại cột Florisilâ Sep-Pak có số hạt nhồi là 51960 và loại cột C18 Sep-Pak có số hạt nhồi là 51910, của Hiệp hội nước (Milwaukee, USA), là ví dụ về những sản phẩm phù hợp sẵn có.
Thông tin đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn này, và không phải là sự xác nhận của tiêu chuẩn đối với chất lượng của chúng. Những sản phẩm tương đương có thể được sử dụng nếu chúng cho những kết quả tương tự.
4) Luerâ là tên thương mại của sản phẩm. Thông tin đưa ra tạo điều kiện thuận lợi cho người sử dụng tiêu chuẩn này nhưng không phải là sự xác nhận của tiêu chuẩn đối với chất lượng của chúng. Những sản phẩm tương đương có thể được sử dụng nếu chúng cho những kết quả tương tự.
5) KOBRAâ là tên thương mại của sản phẩm. Thông tin đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn này nhưng không phải là sự xác nhận của tiêu chuẩn đối với chất lượng của chúng. Những sản phẩm tương đương có thể được sử dụng nếu chúng cho những kết quả tương tự.



